Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Người ta có thể điều chế Cl 2 , Br 2 , I 2 bằng cách cho hỗn hợp dung dịch H 2 SO 4 đặc và MnO 2 tác dụng với muối clorua, bromua, iotua
Các sản phẩm trung gian là HCl, HBr, HI bị hỗn hợp ( MnO 2 + H 2 SO 4 ) oxi hoá thành Cl 2 , Br 2 , I 2 . Các PTHH có thể viết như sau :
NaCl + H 2 SO 4 → Na HSO 4 + HCl
MnO 2 + 4HCl → Mn Cl 2 + Cl 2 + 2 H 2 O
Các phản ứng cũng xảy ra tương tự đối với muối NaBr và NaI.
Không thể áp dụng phương pháp trên để điều chế F 2 vì hỗn hợp oxi hoá ( MnO 2 + H 2 SO 4 ) không đủ mạnh để oxi hoá HF thành F 2
Cách duy nhất điều chế F 2 là điện phân KF tan trong HF lỏng khan Dùng dòng điện một chiểu 8-12 von ; 4000 - 6000 ampe ; Bình điện phân có catôt làm bằng thép đặc biệt hoặc bằng đồng và anôt làm bằng than chì (graphit).
Ở catot: 2 H + + 2 e → H 2
Ở anot: 2 F - → F 2 + 2 e

n Cl 2 = 4,48/22,4 = 0,2 mol
Cl 2 + KBr → KCl + Br 2 (1)
Theo (1): n KBr = 2 n Cl 2 = 2.0,2 = 0,4 mol
m KBr = 119.0,4 = 47,6g
m d d KBr = 88,81.1,34 = 119g
C% = 47,6/119 x 100% = 40%

Điều chế HF, HCl bằng cách cho H 2 SO 4 đặc tác dụng với muối florua, clorua vì H 2 SO 4 à chất oxi hoá không đủ mạnh để oxi hoá được HF và HCl. Nói cách khác, HF và HCl có tính khử yếu, chúng không khử được H 2 SO 4 đặc
Ca F 2 + H 2 SO 4 → Ca SO 4 + 2HF
NaCl + H 2 SO 4 → NaH SO 4 + HCl
Nhưng không thể dùng phương pháp trên để điều chế HBr và HI vì H 2 SO 4 đặc oxi hoá được những chất này thành Br 2 và I 2 . Nói cách khác, HBr và HI là những chất có tính khử mạnh hơn HCl và HF.
NaBr + H 2 SO 4 → HBr + NaH SO 4
2HBr + H 2 SO 4 → Br 2 + SO 2 + 2 H 2 O
NaI + H 2 SO 4 → NaH SO 4 + HI
2HI + H 2 SO 4 → I 2 + SO 2 + 2 H 2 O

Khí Cl 2 khí clo ẩm có tính tẩy màu.
4HCl + MnO 2 → Mn Cl 2 + Cl 2 + 2 H 2 O

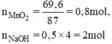
a) Phương trình hóa học của phản ứng:
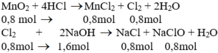
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 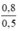 = 1,6 mol/ lit
= 1,6 mol/ lit
CM (NaOH)dư = 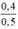 = 0,8 mol/ lit
= 0,8 mol/ lit

2NaI + Mn O 2 + 2 H 2 SO 4 → Na 2 SO 4 + Mn SO 4 + I 2 + 2 H 2 O

\(n_{MnO_2} = \dfrac{4,35}{87} = 0,05(mol)\)
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,05..................................0,05..................(mol)
\(n_{NaOH} = 0,3.0,1 = 0,03(mol)\)
2NaOH + Cl2 → NaCl + NaClO + H2O
0,03........0,05.....0,015.......0,015....................(mol)
Vậy :
\(C_{M_{NaCl}} = C_{M_{NaClO}} = \dfrac{0,015}{0,3} = 0,05M\)

1) Có: \(n_{Cl_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: \(Cl_2+2KBr\rightarrow2KCl+Br_2\)
Số mol: \(0,2\left(mol\right)->0,4\left(mo\right)\)
Theo phương trình, \(n_{KBr}=2n_{Cl_2}=2.0,2=0,4\left(mol\right)\)
\(\Rightarrow m_{KBr}=0,4.119=47,6\left(g\right)\)
Mặt khác, mdung dịch KBr = \(88,81.1,34=119\left(g\right)\)
\(\Rightarrow\) C%dung dịch KBr = \(\dfrac{47,6}{119}.100\%=40\%\)
2)
3) Có: C%dung dịch \(AgNO_3\) = 8,5%; mdung dịch \(AgNO_3\)= 200 (g)
\(\Rightarrow m_{AgNO_3}=\dfrac{200.8,5}{100}=17\left(g\right)\)
\(\Rightarrow n_{AgNO_3}=\dfrac{17}{170}=0,1\left(mol\right)\)
PTHH: \(AgNO_3+HCl\rightarrow AgCl+HNO_3\)
Số mol: 0,1 mol 0,1 mol 0,1 mol 0,1 mol
Theo phương trình trên , ta có: \(n_{AgNO_3}=n_{HCl}=n_{AgCl}=n_{HNO_3}=0,1\left(mol\right)\)
Mặt khác, theo đề: 200 (g) dung dịch AgNO3 (D = 1,025 g/ml)
\(\Rightarrow V_{AgNO_3}=\dfrac{200}{1,025}=195\left(ml\right)=0,195\left(l\right)\)
Có: \(V\)dung dịch sau phản ứng = \(V_{AgNO_3}+V_{HCl}=0,195+0,3=0,495\left(l\right)\)
Sau phản ứng thu được kết tủa AgCl và dung dịch HNO3 nhưng nồng độ mol chỉ áp dung cho dung dịch.
\(\Rightarrow\) CM dung dịch \(HNO_3\) = \(\dfrac{0,1}{0,495}=\dfrac{20}{99}\left(M\right)\)