Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nFe = x mol, theo PT ⇒ nS (1) = nFe = x mol
Gọi nAl = y mol, theo PT ⇒ nS (2) = 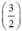 . nAl =
. nAl = 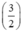 . y mol
. y mol
⇒ nS = x + 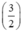 . y = 0,04 mol.
. y = 0,04 mol.
mhh = 56x + 27y = 1,1.
Giải hệ phương trình ta có x = 0,01 mol, y= 0,02 mol.
Tỉ lệ % sắt và nhôm trong hỗn hợp theo lượng chất ( theo số mol là):
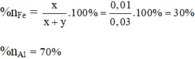
Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp theo khối lượng chất:
mAl = 0,02 x 27 = 0,54g
mFe = 0,01 x 56 = 0,56g.
%mAl = 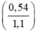 × 100% = 49,09%
× 100% = 49,09%
%mFe = 100% - 49,09% = 50,91%

a)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có (mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl = %.
%mFe = 50,91 %.
Theo lượng chất :
%nAl = 66,67%.
%Fe = 33,33%.
)Phương trình hóa học của phản ứng.
Fe + S -> FeS
xmol xmol
2Al + 3S -> Al2S3.
ymol 1,5y.
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu:
Ta có
(mol).
Ta có hệ phương trình :
Giải hệ phương trình được y = 0,02 => mAl = 0,02.27 = 0,54g.
x = 0,01 => mFe =0,01.56 = 0,56 gam.
%mAl =
%.
%mFe = 50,91 %.
Theo lượng chất :

Fe + S → FeS
x x (mol)
2Al + 3S → t ° Al 2 S 3
y 3y/2(mol)
Đặt số mol Fe, Al lần lượt là x,y ta có hệ phương trình:
56x + 27y = 1,1
(x +3y/2).32 = 1,28
Giải ra x = 0,01 và y = 0,02
% n Fe = 0,01/0,03 x 100% = 33,33%; % n Al = 100 - 33,33% = 66,667%
% m Fe = 56.0,01/1,1 x 100% = 50,90%; % m Al = 100 - 50,90 = 49,1 (%)

a. Fe + S \(\rightarrow\) FeS
2Al + 3S \(\rightarrow\) Al2S3
b. Gọi x, y lần lượt là số mol của sắt và nhôm ta có:
PT: Fe + S \(\rightarrow\) FeS
theo đề x(mol) x(mol)
2Al + 3S \(\rightarrow\) Al2S3
y(mol) (3/2)y (mol)
Theo đề bài ta có hệ: 56x + 27y = 1,1
x + (3/2)y = 1,28/32= 0.04
Giải hệ ta được x= 0.01; y=0.02
KHối lượng sắt trong hỗn hợp là:56x = 56x0.01=0.56 g
+> %Fe=(0.56/1.1)x100%= 50.9%
=> %Al= 100% - 50.9% = 49,1%

a,
| Fe | + | S | → | FeS |
x =>x
| 2Al | + | 3S | → | Al2S3 |
y ==> 3/2* y
b, ta có:
56x + 27 y=1,1 (I)
32x + 32*3/2*y=1,28(II)
từ (I) (II)=>x= 0,01
y= 0,02
suy ra : %nFe= 0,01*100%/(0,01+0,02)= 33,3%
%nAl= 100%-33,3%=66,7%
%mfe= (0,01*56)*100%/1,1=50,9%
%mAl= 100%-50,9%=49,1%

a) Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+27b=1,93\) (1)
Ta có: \(n_S=\dfrac{1,28}{32}=0,04\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,08\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=\dfrac{121}{3800}\left(mol\right)\\b=\dfrac{31}{5700}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=\dfrac{121}{3800}\cdot56\approx1,78\left(g\right)\\m_{Al}\approx0,15\left(g\right)\end{matrix}\right.\)
b) Bảo toàn nguyên tố: \(\Sigma n_{H_2S}=n_{FeS}+3n_{Al_2S_3}=n_{Fe}+6n_{Al}=\dfrac{49}{760}\left(mol\right)\)
\(\Rightarrow V_{H_2S}=\dfrac{49}{760}\cdot22,4\approx1,44\left(l\right)\)


Fe + S ----> FeS
2Al + 3S ----> Al2S3
Gọi x, y tương ứng là số mol Fe và Al.
56x + 27y = 1,1 và x + 1,5y = 1,28/32 = 0,04
Giải hệ thu được: x = 0,01; y = 0,02 mol.
Vậy: mFe/mAl = 56x/27y = 56/54 = 1,037.
x/y = 1/2.