Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
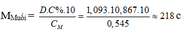
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
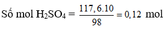
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

M + 2HCl → MCl2 + H2↑
MO + 2HCl → MCl2 + H2O
MCl2 + 2NaOH → M(OH)2↓ + 2NaCl
M(OH)2 → MO + H2O
M + CuCl2 → MCl2 + Cu↓

a) Fe +2HCl---> FeCl2 + H2
Cu ko pư nha
nh2= 3.36/22,4=0,15 mol
thế mol h2 vào phương trình ta được
nh2=nfe=0.15
có mol hết rồi thì bạn tìm mfe=0.15x56=8.4(gam)
mcu=mhh-mfe=10-8.4=1.6(gam)
Vì đồng không tác dụng với HCl loãng :
\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
0,15 0,15
b) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Cu}=10-8,4=1,6\left(g\right)\)
c) Cả hai chất đều xảy ra phản ứng :
Pt : \(Cu+H_2SO_{4đặc}\underrightarrow{t^o}CuSO_4+SO_2+H_2O\)
\(2Fe+6H_2SO_{4đặc}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
Chúc bạn học tốt

nH2=0,1(mol)
PTHH: Mg + 2 HCl -> MgCl2 + H2
0,1__________0,2___________0,1(mol)
MgO + 2 HCl -> MgCl2 + H2O
0,05____0,1___0,05(mol)
mMg=0,1. 24= 2,4(g) -> mMgO=4,4-2,4= 2(g) -> nMgO=0,05((mol)
b) %mMg= (2,4/4,4).100=54,545%
=> %mMgO=45,455%
c) nHCl=0,3(mol) -> mHCl=0,3.36,5=10,95(g)
=> mddHCl=(10,95.100)/7,3=150(g)



Bài 3:
Khi cho tác dụng với HCl thì chỉ có Zn phản ứng
Zn + 2HCl ----> ZnCl2 + H2 (1)
0.2mol <------------------------- 0.2mol
Vậy khối lượng Zn = 13g
Nung hh trên trong không khí sẽ có các phản ứng:
Zn + O2 ----> ZnO (2)
0.2mol -----------------> 0.2mol = 16.2g
Cu + 1/2O2 ----> CuO
Ta nhận thấy Ag không phản ứng với Ôxi vậy khối lượng chất rắn tăng lên là do sự hình thành 2 ôxit ZnO và CuO. Số mol của O trong hổn hợp 2 ôxit = (51.9 - 45.5) / 16 = 0.4 mol
Theo PT (2) ta thấy số mol của O trong ZnO =số mol của ZnO = 0.2 mol, vậy số mol của O trong CuO = 0.4 - 0.2 = 0.2 mol. Số mol của Cu = 0.2 mol -> khối lượng Cu ban đầu = 0.2 * 64 = 12.8g
Khối lượng Ag trong hh ban đầu = 45.5 - 12.8 - 13 = 19.7g.
Vì Cu và Ag là hai kim loại đứng sau H2 trong dãy hoạt động của kim loại nên không thể tác dụng được với dd HCl
Theo bài ra ta có: \(nH_2=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a) PTHH:
\(Z_n+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
\(0,2mol....................0,2mol\)
\(2Cu+O_2-^{t0}\rightarrow2CuO\)
\(2Zn+O_2-^{t0}\rightarrow2ZnO\)
\(0,2mol.......................0,2mol\)
\(Ag+O_2\ne ko-pư\)
Chất rắn thu được sau khi nung là CuO, ZnO và Ag.
Gọi x,y lần lượt là số mol của Cu và Ag
Ta có:
mZnO + mCuO + mAg = 51,9
mZn + mCu + mAg = 45,5
Ta có:
mCu + mAg = 45,5 - 0,2.65
⇔ 64x + 108y = 32,5 (1)
mCuO + mAg = 51,9 - 0,2.81
⇔ 80x + 108y = 35,7 (2)
Từ (1) và ( 2) ta được: \(\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,182\left(mol\right)\end{matrix}\right.\)
b) Thành phần % theo khối lượng có trong hỗn hợp ban đầu là:
\(\left\{{}\begin{matrix}\%mZn=\dfrac{0,2.65}{45,5}.100\%\approx28,57\%\\\%mCu=\dfrac{0,2.64}{45,5}.100\%\approx28,133\%\\\%mAg=100\%-28,75\%-28,13\%=43,3\%\end{matrix}\right.\)