Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do tính khử HBr, HI lớn, nó sẽ tác dụng với H2SO4 đặc nóng sinh ra Br2, I2 nên không thể điều chế HBr và HI theo phương pháp sunfat.

Gọi n là hóa trị của kim loại R cần tìm
\(2R + nH_2SO_4 \to R_2(SO_4)_n + nH_2\\ n_R = 2n_{R_2(SO_4)_n}\\ \Rightarrow \dfrac{2,52}{R} = \dfrac{6,84}{2R + 96n}\\ \Rightarrow R = 28n\)
Với n = 2 thì R = 56(Fe)
Vậy kim loại đó là Sắt

Chọn đáp án C
1. Bán kính của S lớn hơn bán kính F. Chuẩn
2. Tính khử và tính oxi hóa của HBr đều mạnh hơn HF. Sai tính oxh của HF max
3. Có 2 HX ( X: halogen ) có thể điều chế bằng cách cho NaX tác dụng với dung dịch H2SO4 đậm đặc.
Chuẩn đó là HCl và HF (HI và HBr không điều chế được vì phản ứng với H2SO4 đậm đặc)
4. Tính khử của I- mạnh hơn F-. Chuẩn
5. Trong công nghiệp, người ta không sản xuất các khí SO2, H2S.Chuẩn
6. Tất cả các halogen đều không có ở dạng đơn chất trong thiên nhiên. Chuẩn
7. Để thu được dung dịch H2SO4, trong công nghiệp, người ta cho nước vào oleum
Sai.Phải cho ngươc lại (oleum vào nước)

a) Các đặc điểm của phản ứng hoá học nung vôi :
- Phản ứng thuận nghịch.
- Phản ứng thuận thu nhiệt.
- Phản ứng thuận có sản phẩm tạo thành là chất khí.
b) Những biện pháp kĩ thuật để nâng cao hiệu suất nung vôi:
- Chọn nhiệt độ thích hợp.
- Tăng diện tích tiếp xúc của chất rắn (CaC O 3 ) bằng cách đập nhỏ đá vôi đến kích thước thích hợp.
- Thổi không khí nén (trong công nghiệp) hay chọn hướng gió thích hợp để tăng nồng độ khí oxi cung cấp cho phản ứng đốt cháy than, đồng thời làm giảm nồng độ khí cacbon đioxit.

Mg + dung dịch H 2 SO 4 loãng sinh ra khí hiđro.
Mg + H 2 SO 4 → Mg SO 4 + H 2

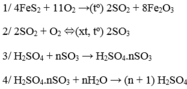
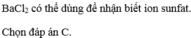
1) Dùng để sản xuất thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hóa học, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ, ...
2) Các công đoạn sản xuất H2SO4:
- Sản xuất SO2 (Đốt cháy lưu huỳnh/đốt quặng pirit sắt)
- Sản xuất SO3 (Oxi hóa SO2 bằng oxi/không khí dưở 450-500oC, xúc tác V2O5)
- Hấp thụ SO3 bằng H2SO4 (Dùng H2SO4 98% hấp thụ SO3 được oleum, dùng lượng nước thích hợp để pha loãng oleum)
3)
- Gồm 2 loại:
+ Muối trung hòa (muối sunfat): chứa ion SO42-
+ Muối axit (muối hidrosunfat): chứa ion HSO4-
4)
- Thường dùng dd muối bari hoặc dd Ba(OH)2