Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Sản xuất công nghiệp là sản xuất với số lượng lớn, do đó cần nguyên liệu đầu vào vừa rẻ lại sẵn có trong tự nhiên là tốt nhất.
Muối ăn NaCl sẵn có trong nước biển, nên việc dùng NaCl bão hòa để điều chế Clo bằng pp điện phân sẽ thuận tiện hơn rất nhiều và chi phí rẻ hơn so với việc dùng hóa chất khác.
Mặt khác, các pp như nhiệt phân, thủy luyện, ... đều không thu được khí clo.
Sản xuất công nghiệp là sản xuất với số lượng lớn, do đó cần nguyên liệu đầu vào vừa rẻ lại sẵn có trong tự nhiên là tốt nhất.
Muối ăn NaCl sẵn có trong nước biển, nên việc dùng NaCl bão hòa để điều chế Clo bằng pp điện phân sẽ thuận tiện hơn rất nhiều và chi phí rẻ hơn so với việc dùng hóa chất khác.
Mặt khác, các pp như nhiệt phân, thủy luyện, ... đều không thu được khí clo.

Trong công nghiệp không dùng phản ứng oxi hóa – khử giữa các hóa chất để điều chế clo vì giá thành sản phẩm rất cao.

a. Sơ đồ pin: (-) Ni-Ag (+)
Thế của cặp oxi/khử nào lớn hơn thì kim loại đó là cực dương của pin điện.
b. Epin = E (+) - E (-) = E0 Ag+/Ag - E0 Ni2+/Ni = 1,029

Câu 1. Phản ứng nào sau đây thuộc loại phản ứng oxi hóa – khử? Xác định chất oxi hóa và chất khử trong các phản ứng oxi hóa khử đó.
(1) 2SO2 + O2 → 2SO3.
Chất khử : SO2
Chất oxi hóa: O2
(2) Fe2O3 + CO → 2FeO + CO2.
Chất khử : CO
Chất oxi hóa: Fe2O3
(3) 2H2S + SO2 → 3S + 2H2O.
Chất khử : 2H2S
Chất oxi hóa: SO2
(4) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
Chất khử : HCl
Chất oxi hóa: MnO2
(5) 2H2O2 → 2H2O + O2.
Chất khử : H2O2
Chất oxi hóa: H2O2
(6) 2KClO3 → 2KCl + 3O2.
Chất khử : KClO3
Chất oxi hóa: KClO3
(7) P2O5 + 3H2O → 2H3PO4.
Không có chất khử và chất oxi hóa:
(8) KOH + CO2 → KHCO3.
Không có chất khử và chất oxi hóa:
(9) Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O.
Chất khử : Fe
Chất oxi hóa: HNO3
(10) 2Al + Fe2O3 → Al2O3 + 2Fe
Chất khử : Al
Chất oxi hóa: Fe2O3

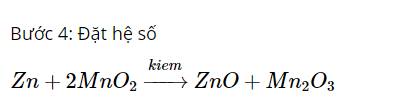
Câu 1
- Khái niệm: Phản ứng oxi hóa - khử là phản ứng hoá học trong đó có sự chuyển electron giữa các chất phản ứng.
- Chất oxi hoá ( chất bị khử ): là chất nhận electron hay là chất có số oxi hoá giảm sau phản ứng.
- Chất khử ( chất bị oxi hoá ): là chất nhường electron hay là chất có số oxi hoá tăng sau phản ứng.
- Sự khử : là quá trình làm cho chất đó nhận electron hay làm giảm số oxi hoá của chất đó.
- Sự oxi hoá : là quá trình làm cho chất đó nhường electron hay làm tăng số oxi hoá của chất đó.
- Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa - khử của kim loại.