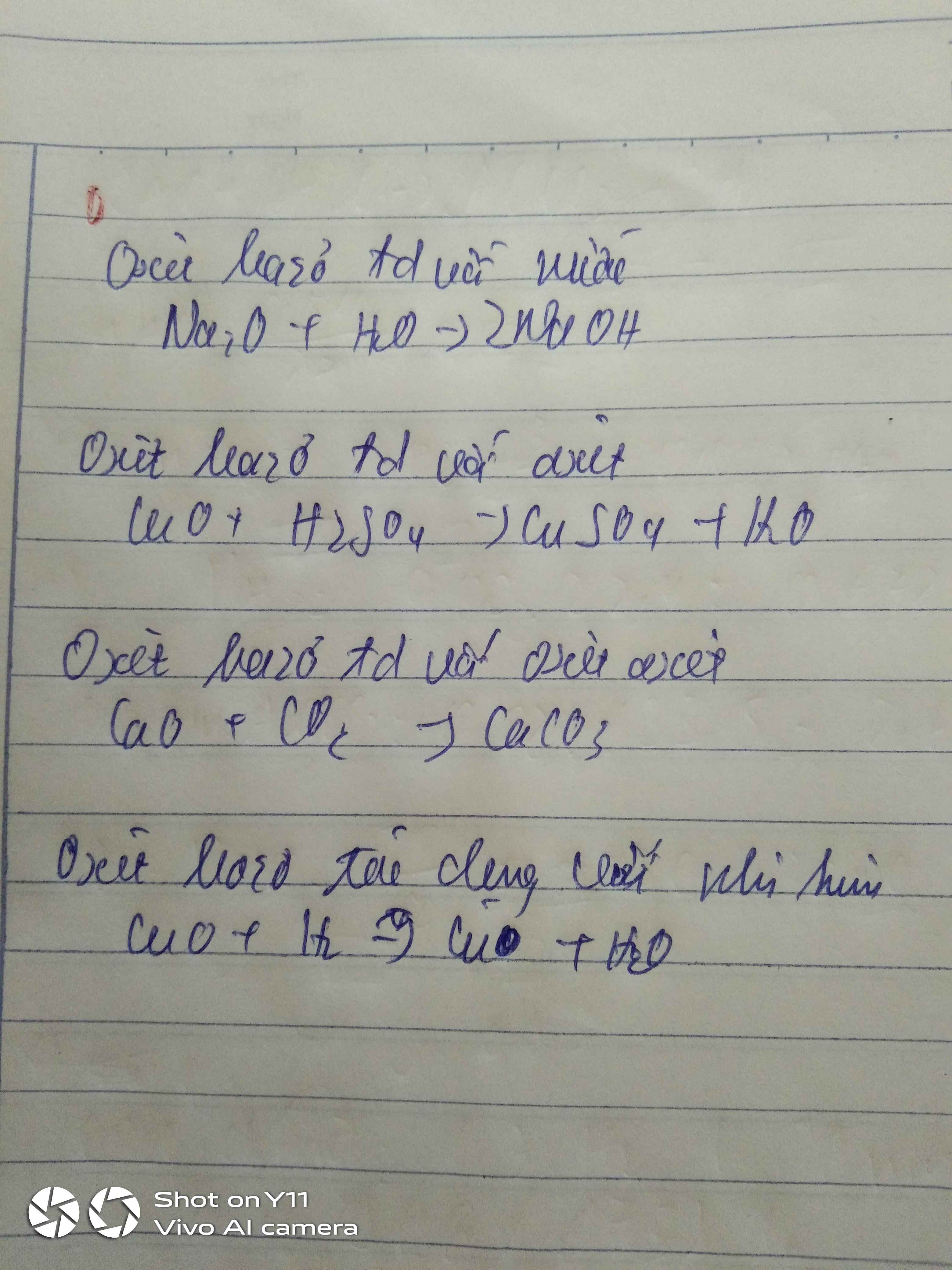Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
+ Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt
+ Tác dụng với Hiđro, Phản ứng có thể gây nổ mạnh nếu tỉ lệ phản ứng O2:H2 = 1:2
+ Tác dụng với một số phi kim khác:
+ Tác dụng với một số hợp chất:
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.

a) Al2O3
b) Ca3(PO4)2
c) Fe2O3
d) Mg(OH)2
e) H2SO4
f) NaOH
g) BaSO4
h) K2CO3
i) NO2
k) Cu(NO3)2
l) Na3PO4
m) K2SO3
n) AlCl3
o) ZnCl2
p) CO
Câu 1: Viết công thức hóa học của các hợp chất có tên gọi sau và cho biết chúng thuộc loại hợp chất vô cơ nào?
a) Nhôm oxit : \(Al_2O_3\) (Oxit)
b) Canxi photphat : \(Ca_3\left(PO_4\right)_2\) (Muối)
c) Sắt (III) oxit: \(Fe_2O_3\) (oxit)
d) Magie hiđroxit: \(Mg\left(OH\right)_2\) (Bazo)
e) axit sunfuric \(H_2SO_4\) (axit)
f) Natri hiđroxit: \(NaOH\) (bazo)
g) Bari sunfat: \(BaSO_4\) (Muối)
h) kali cacbonat: \(K_2CO_3\) (Muối)
i) Nitơ đioxit: \(NO_2\) (oxit)
k) Đồng (II) nitrat: \(Cu\left(NO_3\right)_2\) (Muối)
l) Natri photphat: \(Na_3PO_4\) (Muối)
m) Kali sunfit: \(K_2SO_3\) (Muối)
n) Nhôm clorua: \(AlCl_3\) (Muối)
o) Kẽm sunfua: \(ZnS\) (Muối)
p) Cacbon oxit: \(CO\) (Oxit)

C1: Một số oxit bazo td H2O ra bazo tương ứng( Li, K, Ba, Ca, Na)
\(Na + H_2O \rightarrow NaOH + \dfrac{1}{2} H_2\)
Tác dụng dd axit tạo ra muối + H2O
\(MgO + 2HCl \rightarrow MgCl_2 + H_2O\)
Tác dụng với oxit axit tạo ra muối
\(CaO + CO_2 \rightarrow CaCO_3\)( có to)
C2)
Hầu hết oxit axit tác dụng với nước tạo ra axit( trừ SiO2)
\(SO_3 + H_2O \rightarrow H_2SO_4\)
Tác dụng với bazo ( dư) tạo ra muối và nước
\(2NaOH + CO_2 \rightarrow Na_2CO_3 + H_2O\)
Tác dụng với 1 số oxit bazo tạo muối
\(CaO + CO_2 \rightarrow^{t^o} CaCO_3\)
C3)
Làm đổi màu chất chỉ thị ( làm quỳ tím chuyển đỏ)
Tác dụng kim loại ( trước H) tạo ra muối và khí H2
\(Mg + 2HCl \rightarrow MgCl_2 + H_2\)
Tác dụng với oxit bazo tạo ra muối và nước
\(MgO + 2HCl \rightarrow MgCl_2 + H_2O\)
Tác dụng với bazo tạo ra muối và nước
\(Mg(OH)_2 + 2HCl \rightarrow MgCl_2 + 2H_2O\)
Tác dụng muối tạo muối mới cộng axit mới( điều kiện: 2 chất pư phải tan, sản phẩm ít nhất 1 chất rắn, nếu muối tham gia là chất rắn của gốc axit yếu là các gốc SO3, CO3 và S tan trong axit mạnh là axit có gốc SO4, Cl, NO3, sản phẩm có khí khác H2 hoặc rắn) rắn là muối không tan trong nước nhé
\(Na_2CO_3 + 2HCl \rightarrow 2NaCl + CO_2 + H_2O\)
\(BaCl_2 + H_2SO_4 \rightarrow BaSO_4 + 2HCl\)
C4)
PTN: Cho kim loại tác dụng H2SO4 đặc, nóng
\(Mg + 2H_2SO_4 đặc, nóng \rightarrow MgSO_4 + SO_2 + 2H_2O\)
Công nghiệp:
Đốt cháy quặng firit sắt (\(FeS_2\))
\(2FeS_2 + \dfrac{11}{2}O_2 \rightarrow^{t^o} Fe_2O_3 + 4SO_2\)
Tham khảo nhé :
Tính chất hoá học của Oxit (Oxit bazo, Oxit axit)
1. Tính chất hoá học của Oxit bazơ
a) Oxit bazo tác dụng với nước
- Một số oxit bazơ tác dụng với nước ở nhiệt độ thường là : Na2O; CaO; K2O; BaO;... tạo ra bazơ tan (kiềm) tương ứng là: NaOH, Ca(OH)2, KOH, Ba(OH)2
• Oxit bazơ + H2O → Bazơ
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
BaO + H2O → Ba(OH)2
b) Oxit bazo tác dụng với axit
- Oxit bazơ tác dụng với axit tạo thành muối và nước.
• Oxit bazơ + axit → muối + nước
Ví dụ:
CuO + 2HCl → CuCl2 + H2O
CaO + 2HCl → CaCl2 + H2O
Na2O + H2SO4 → Na2SO4 + H2O
c) Oxit bazo tác dụng với oxit axit
- Một số oxit bazơ (CaO, BaO, Na2O, K2O,...) tác dụng với oxit axit tạo thành muối.
• Oxit bazơ + Oxit axit → muối
Na2O + CO2 → Na2CO3
CaO + CO2 → CaCO3↓
BaO + CO2 → BaCO3↓
* Lưu ý: Oxit bazo tác dụng được với nước thì tác dụng với Oxit axit
2. Tính chất hoá học của Oxit axit
- Oxit axit ngoài cách gọi tên như trên còn có cách gọi khác là: ANHIDRIC của axit tương ứng.
Ví dụ: SO2: Anhidric sunfurơ (Axit tương ứng là H2SO3: axit sunfurơ)
a) Oxit axit tác dụng với nước
- Nhiều oxit axit tác dụng với nước tạo thành dung dịch axit.
- Một số oxit axit tác dụng với nước ở điều kiện thường như: P2O5, SO2, SO3, NO2, N2O5, CO2, CrO3,.. tạo ra axit tương ứng như: H3PO4, H2SO3, H2SO4, HNO3, H2CO3, H2Cr2O7,...
• Oxit axit + H2O → Axit
Ví dụ:
4NO2 + 2H2O + O2 → 4HNO3
CO2 + H2O → H2CO3
CrO3 + H2O → H2CrO4 → H2Cr2O7
N2O5 + H2O → 2HNO3
SO3 + H2O → H2SO4
* Chú ý: NO, N2O, CO không tác dụng với nước ở điều kiện thường (nhiệt độ thường).
b) Oxit axit tác dụng với bazơ
- Oxit axit tác dụng với dung dịch bazơ tạo thành muối và nước.
Ví dụ:
CO2 + Ca(OH)2 CaCO3 + H2O
P2O5 + NaOH → Na3PO4 + H2O
SO3 + NaOH → NaHSO4 (muối axit)
NaHSO4 + NaOH → Na2SO4 + H2O (muối trung hòa)
SO3 + 2NaOH → Na2SO4 + H2O
c) Oxit axit tác dụng với oxit bazơ
- Oxit axit tác dụng với một số Oxit bazơ (CaO, BaO, Na2O, K2O,...) tạo thành muối.
Ví dụ:
Na2O + SO2 → Na2SO3
CO2 (k) + CaO → CaCO3
Tính chất hóa học của axit:
1. Axit làm đổi màu chất chỉ thị: Dung dịch axit làm đổi màu quỳ tím thành đỏ.
2. Axit tác dụng với kim loại
Dung dịch axit tác dụng được với một số kim loại tạo thành muối và giải phóng khí hiđro
Thí dụ:
3H2SO4 (dd loãng) + 2Al → Al2(SO4)3 + 3H2
2HCl + Fe → FeCl2 + H2
Những kim loại không tác dụng với HCl, H2SO4 loãng như Cu, Ag, Hg,…
Chú ý: Axit HNO3 và H2SO4 đặc tác dụng được với nhiều kim loại nhưng không giải phóng hiđro.
Điều chế so2
Tính chất hóa học của axit:
1. Axit làm đổi màu chất chỉ thị: Dung dịch axit làm đổi màu quỳ tím thành đỏ.
2. Axit tác dụng với kim loại
Dung dịch axit tác dụng được với một số kim loại tạo thành muối và giải phóng khí hiđro
Thí dụ:
3H2SO4 (dd loãng) + 2Al → Al2(SO4)3 + 3H2
2HCl + Fe → FeCl2 + H2
Những kim loại không tác dụng với HCl, H2SO4 loãng như Cu, Ag, Hg,…
Chú ý: Axit HNO3 và H2SO4 đặc tác dụng được với nhiều kim loại nhưng không giải phóng hiđro.

Bài 1:
Ý 1)
\(a,Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ b,\left(1\right)4K+O_2\rightarrow2K_2O\\ \left(2\right)K_2O+H_2O\rightarrow2KOH\\ \left(2\right)Bazo\rightarrow KL\left(K.có\right)\)
Ý 2)
\(a,Mg+FeSO_4\rightarrow MgSO_4+Fe\\ b,CuSO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+Cu\left(OH\right)_2\\ Cu\left(OH\right)_2\rightarrow\left(t^o\right)CuO+H_2O\\ CuO+CO\rightarrow\left(t^o\right)Cu+CO_2\)