Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

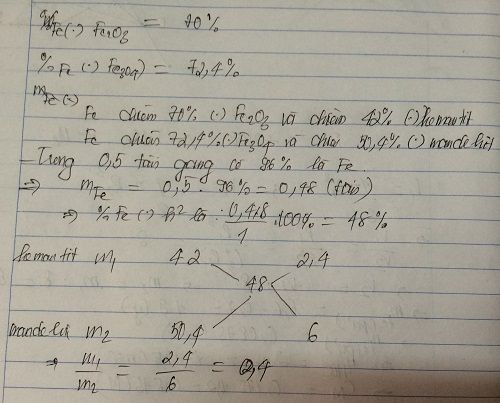
đề sai sai nha !
X là quặng hematit chứa 60% Fe2O3, Y là quặng manhetit chứa 69,6% Fe3O4. Cần trộn X, Y theo tỉ lệ khối lượng như thế nào để được quặng Z mà từ 1 tấn quặng Z có thể điều chế được 0,5 tấn gang chứa 96% sắt?OK!

a. nH2 = nFe = 0,1mol
Bảo toàn nguyên tố Fe => nFe2O3 = 0,05mol
=> mFe2O3 = 8g
=> %Fe2O3 = (8:10) . 100% = 80%

Ta có: mFe = 1000.96% = 960 (kg)
\(\Rightarrow n_{Fe}=\dfrac{960}{56}=\dfrac{120}{7}\left(kmol\right)\)
BTNT Fe: \(n_{Fe_2O_3\left(LT\right)}=\dfrac{1}{2}n_{Fe}=\dfrac{60}{7}\left(kmol\right)\)
\(\Rightarrow m_{Fe_2O_3\left(LT\right)}=\dfrac{60}{7}.160=\dfrac{9600}{7}\left(kg\right)\)
Mà: H = 80%
\(\Rightarrow m_{Fe_2O_3\left(TT\right)}=\dfrac{m_{Fe_2O_3\left(LT\right)}}{80\%}\approx1714,3\left(kg\right)=1,7143\) (tấn)

Khối lượng Fe có trong quặng: 1x64,15/100 = 0,6415 tấn
Khối lượng Fe có trong gang: 0,6415 x (100-2)/100 = 0,62867 tấn
Khối lượng gang sản xuất được: 0,62867 x 100/95 ≈ 0,662 tấn

Quặng Pirit (FeS2)---------> SO2
Bảo toàn nguyên tố S: \(n_{FeS_2}.2=n_{SO_2}.1=\dfrac{50000}{22,4}=\dfrac{15625}{7}\Rightarrow n_{FeS_2}=\dfrac{15625}{14}\)(mol)
Vì H=95% => \(n_{FeS_2}=\dfrac{15625}{14}.\dfrac{100}{95}=1174,81\left(mol\right)\)
=> \(m_{FeS_2}=1174,81.120=140977,2\left(kg\right)\)
Vì quặng pirit chứa 98% FeS2
=> \(m_{quặng}=140977,2.\dfrac{100}{98}=143854,3\left(kg\right)\approx143,85\left(tấn\right)\)

m\(Fe_2O_3\) có trong quặng = 1000000 . 58% = 580000 (g)
n\(Fe_{2_{ }}O_3\) = \(\frac{580000}{160}\)= 10357,143(mol)
Ta có PT : Fe2O3 + 3H2 ------> 2Fe + 3H2O
Theo PT ta có : nFe = \(\frac{1}{2}\)n\(Fe_2O_3\)=\(\frac{1}{2}\). 10357,143 = 5178,571(mol)
mFe = 5178,571 . 56 = 290000 (g)
Vì H= 85% nên ta có :
mFe thu được = 290000 . 85% = 246500 (g)
mgang thu được = 246500 . \(\frac{100}{95,5}\)= 258115,1832(g)

mFe = 1000 x 95 / 100 = 950kg
Phương trình phản ứng:
Fe2O3 + 3CO → 2Fe + 3CO2(to cao)
160kg Fe2O3 tạo ra 2 x 56kg Fe
x kg Fe2O3 tạo ra 950 kg Fe
x = 160 x 950 / 112 = 1357,14kg
Khối lượng Fe2O3 cần dùng: 1357,14 x 100 / 80 = 1606,425kg
Khối lượng quặng hematit chứa 60% Fe2O3 cần dùng:
1696,425 x 100 /60 ≈ 2827,375kg.

