GiuGiúp mình giải nhanh voi 5 hòa tan 20g hỗn hợp Al,Fe, Cu vào dung dịch H2so4 loãng dư thu được 8.92 lít H2 đkc và 9g 1 chất rắn ko tan . Tính % lượng mỗi kim loại trong hỗn hợp 6 hòa tan hoàn toàn 28.2 g hôn hợp FeS và ZnS vào lượng vua đủ dung dịch hcl thì thu được 6.72 lít khí đkc tính % lượng mỗi chất trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 3 :
$R_2CO_3 + 2HCl \to 2RCl + CO_2 + H_2O$
n H2O = n CO2 = 6,72/22,4 = 0,3(mol)
n HCl = 2n CO2 = 0,6(mol)
Bảo toàn khối lượng :
m muối = 38,2 + 0,6.36,5 - 0,3.44 + 0,3.18 = 41,5(gam)
Bài 4 :
n H2 = 5,6/22,4 = 0,25(mol)
$Fe + 2HCl \to FeCl_2 + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
n HCl = 2n H2 = 0,5(mol)
Bảo toàn khối lượng :
m muối = 10 + 0,5.36,5 - 0,25.2 = 27,75(gam)

Chất rắn không tan là Cu.
⇒ mCu = 9 (g)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 27x + 56y = 20 - 9 (1)
Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y=0,4\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{9}{20}.100\%=45\%\\\%m_{Al}=\dfrac{0,2.27}{20}.100\%=27\%\\\%m_{Fe}=28\%\end{matrix}\right.\)

Cu + H2SO4 -/->
Gọi x,y là số mol lần lượt của Al và Fe
2Al+3H2SO4->Al2(SO4)3+ 3H2 (1)
Fe + H2SO4 -> FeSO4 + H2 (2) nH2 = 8.96/22.4 = 0.4(Mol)
(1) nAl = 2x(mol)-> nH2 = 3x (mol)
(2) nFe= y -> H2 = y
mAl=2x * 27 = 54(g)
mFe = y * 56 = 56y
Từ đó ta có hệ pt :
3x+y=0.4.
54x+56y=11
Bấm mt ta đc:
x= 0.1. y= 0.1
%Cu= 9/20 * 100 = 45%
%Fe = 5.6/20 * 100= 28%
%Al = 5.4/20 *100= 27%

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 ( mol )
\(m_{Al}=0,2.27=5,4g\)
\(\%m_{Al}=\dfrac{5,4}{10}.100=54\%\)
\(\%m_{Cu}=100\%-54\%=46\%\)
viết pthh của pư
tính % khối lượng khối lượng của kim loại trong hỗn hợp

Chọn A.
Có m(hh khí) = 6,11; n(hh khí) = 0,13
=> n(Cl2) = 0,05; n(O2) = 0,08.
Hòa tan hết Y trong HCl nên có: n(HCl) = 2.n(H2O) = 2.n(O2-) = 0,32 mol
- BTNT (Cl):
n(Cl- trong Z) = n(AgCl) = n(HCl) + n(Cl-) = 0,32 + 0,1 = 0,42. → m(AgCl) = 0,42.143,5 = 60,27 gam
→ m(kết tủa) = m(AgCl) + m(Ag) → m(Ag) = 73,23 – 60,27 = 12,96 → n(Ag) = 0,12 mol.
=> n(Fe2+) = 0,12.
BTĐT trong Z: 2.0,12 + 2.n(Cu) = 0,42 => n(Cu) = 0,09.
Vậy X chứa Fe (0,12) và Cu(0,09).
Khi X tác dụng HNO3, ta thấy: (0,12 × 3 + 0,09 × 2) ÷ 3 = 0,18 mol > n(NO) = 0,15 mol
có nghĩa là Fe không lên hết Fe3+ mà có 1 phần chỉ lên Fe2+
Khi phản ứng với HNO3: nFe(III) = a mol ; nFe(II) = bmol. ta có hệ:
a + b = 0,12
3a + 2b + 0,09.2 = 0,15.3
Giải hệ: a = 0,03; b = 0,09.
Vì HNO3 dùng hết, n(HNO3) = 4n(NO) = 0,6 mol → m(HNO3) = 37,8 → m(dd HNO3) = 120 gam.
→ BTKL: m(dd T) = m(X) + m(HNO3) – m(NO) = 127,98 gam.
C%(Fe(NO3)3 trong T) = 0,03 . 242 : 127,98 ≈ 5,67%.

Bài 1:
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Fe}\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{37,6}\cdot100\%\approx14,89\%\)
\(\Rightarrow\%m_{Fe_2O_3}=85,11\%\)
Bài 3:
PTHH: \(2HNO_3+Ba\left(OH\right)_2\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{HNO_3}=0,05\cdot1=0,05\left(mol\right)\\n_{Ba\left(OH\right)_2}=\dfrac{342\cdot5\%}{171}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,05}{2}< \dfrac{0,1}{1}\) \(\Rightarrow\) Axit p/ứ hết, Bazơ còn dư sau p/ứ
\(\Rightarrow\) Dung dịch sau p/ứ làm quỳ tím hóa xanh
Theo PTHH: \(n_{Ba\left(NO_3\right)_2}=\dfrac{1}{2}n_{HNO_3}=0,025\left(mol\right)\) \(\Rightarrow m_{Ba\left(NO_3\right)_2}=0,025\cdot261=6,525\left(g\right)\)

a, Ta có: 27nAl + 56nFe = 27,8 (1)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{17,353}{24,79}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{27,8}.100\%\approx19,42\%\\\%m_{Fe}\approx80,58\%\end{matrix}\right.\)
b, \(n_{H_2SO_4}=n_{H_2}=0,7\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,7}{0,5}=1,4\left(M\right)\)

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,1 0,1
\(m_{Zn}=0,1.65=6,5\left(g\right)\Rightarrow\%m_{Zn}=\dfrac{6,5.100\%}{20}=32,5\%\)
\(\%m_{Cu}=100-32,5=67,5\%\)
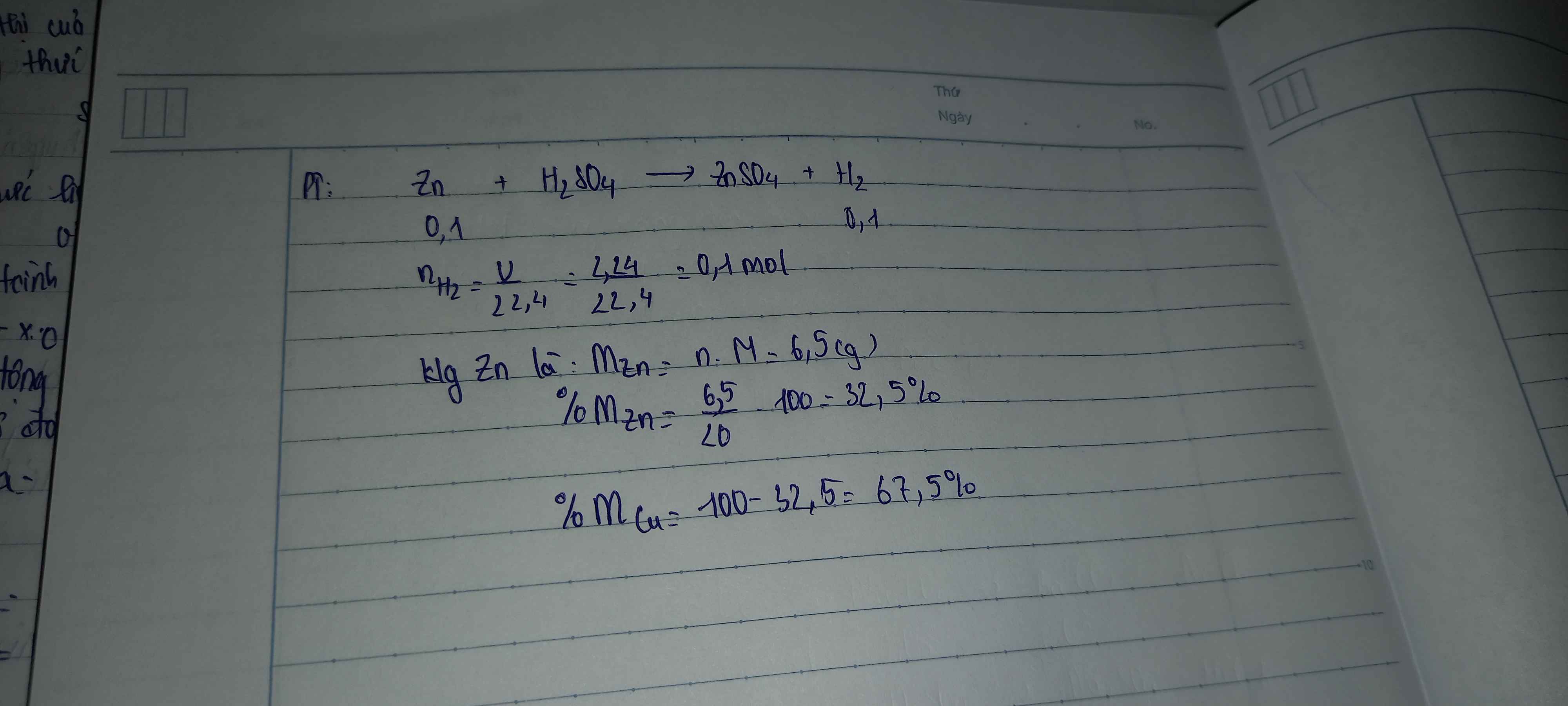
Bài 5:
Ta có: mCu = 9 (g)
⇒ mAl + mFe = 20 - 9 = 11 (g)
Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 56y = 11 (1)
Ta có: \(n_{H_2}=0,4\left(mol\right)\)
Theo ĐLBT mol e, có: 3x + 2y = 0,4.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{20}.100\%=27\%\\\%m_{Fe}=\dfrac{0,1.56}{20}.100\%=28\%\\\%m_{Cu}=45\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Bài 6:
Giả sử: \(\left\{{}\begin{matrix}n_{FeS}=x\left(mol\right)\\n_{ZnS}=y\left(mol\right)\end{matrix}\right.\)
⇒ 88x + 97y = 28,2 (1)
Ta có: \(n_{H_2S}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
BTNT S, có: x + y = 0,3 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeS}=\dfrac{0,1.88}{28,2}.100\%\approx31,2\text{% }\\\%m_{ZnS}\approx68,8\%\end{matrix}\right.\)
Bạn tham khảo nhé!