cho 200ml dd HCl 2M tác dụng với 100g dd NaOH 8% thu được dd X
a/cho quỳ tím vào dd X quỳ tím sẽ chuyển thành màu j? tại sao?
b/cô cạn dd X thu được m gam chất rắn khan. Tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(C_{MddHCl}=\dfrac{n}{v}=>^nHCl=0,06\left(mol\right)\)
\(C_{MddBa\left(OH\right)_2}=\dfrac{n}{v}=>^nBa\left(OH\right)_2=0,04\left(mol\right)\)
\(2HCl+Ba\left(OH\right)_2->BaCl_2+2H_2O\)
0,06 0,03
\(\dfrac{0,06}{3}< \dfrac{0,04}{1}=>Ba\left(OH\right)_2\)dư => làm quỳ tím chuyển màu xanh
Khi cô cặn dd X thì có 0,01 mol \(Ba\left(OH\right)_2\)dư và 0,03 mol \(BaCl_2\)
=> \(^mcr=0,01.171+0,03.208=7,95\left(g\right)\)

Đáp án B
Do X phản ứng với dd NaOH sinh ra khí Y làm chuyển màu quỳ tím
=> Y là NH3 hoặc amin RNH2.
Mà MY> 29 => Y là amin
Dung dịch Z làm mất màu quỳ tím nên Z có liên kết pi
⇒ CTCT của X là : CH2=CHCOONH3CH3
![]()
mmuối khan = 10,3:103.94 = 9,4

Đáp án B
X có công thứ CH6O3N2 tác dụng NaOH sinh ra chất khí làm xanh giấy quỳ → X có cấu tạo CH3NH3NO3
CH3NH3NO3 +NaOH → CH3NH2 + NaNO3 + H2O
Thấy nX < nNaOH → NaOH còn dư : 0,1 mol
mchất rắn = mNaNO3 + mNaOH dư = 0,1. 85 + 0,1. 40 = 12,5 gam
Đáp án B.

\(n_{HCl}=1.0,1=0,1(mol);n_{NaOH}=1,5.0,2=0,3(mol)\\ PTHH:NaOH+HCl\to NaCl+H_2O\)
Vì \(\dfrac{n_{HCl}}{1}<\dfrac{n_{NaOH}}{1}\) nên \(NaOH\) dư
Vậy dd X gồm \(NaOH\) và \(NaCl\) sẽ làm quỳ tím hóa xanh

Đáp án B
![]()
X có dạng công thức CnH2n+4O3N2 nên X là muối nitơrat của amin: CH3NH3NO3
Phản ứng hóa học:
![]()
Sau phản ứng chất rắn thu được chứa:
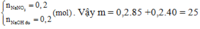

Bài 10 :
Khối lượng của natri hidroxit
C0/0NaOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{8.100}{100}=8\left(g\right)\)
Số mol của natri hidroxit
nNaOH = \(\dfrac{m_{NaOH}}{M_{NaOH}}=\dfrac{8}{40}=0,2\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{9,8.150}{100}=14,7\left(g\right)\)
Số mol của axit sunfuric
nH2SO4= \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{14,7}{98}=0,15\left(mol\right)\)
Pt : 2NaOH + H2SO4 → Na2SO4 + 2H2O\(|\)
2 1 1 2
0,2 0,15 0,1
a) Lập tỉ số so sánh : \(\dfrac{0,2}{2}< \dfrac{0,15}{1}\)
⇒ NaOH phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của NaOH
Vì lượng H2SO4 còn dư nên khi ta nhúng quỳ tím vào , quỳ tím sẽ hóa đỏ
b) Số mol của natri sunfat
nNa2SO4 = \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Khối lượng của natri sunfat
mNa2SO4 = nNa2SO4 . MNa2SO4
= 0,1. 142
= 14,2 (g)
Số mol dư của dung dịch axit sunfuric
ndư = nbanđầu - nmol
= 0,15 - (\(\dfrac{0,2.1}{2}\))
= 0,05 (mol)
Khối lượng dư của dung dịch axit sunfuric
mdư = ndư . MH2SO4
= 0,05 . 98
= 4,9 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mNaOH + mH2SO4
= 100 + 150
= 250 (g)
Nồng độ phần trăm của natri sunfat
C0/Na2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{14,2.100}{250}=5,68\)0/0
Nồng độ phần trăm của dung dịch axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{4,9.100}{250}=1,96\)0/0
Chúc bạn học tốt
Bài 11 :
Khối lượng của đồng (II) sunfat
C0/0CuSO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{16.50}{100}=8\left(g\right)\)
Số mol của đồng (II) sunfat
nCuSO4 = \(\dfrac{m_{CuSO4}}{M_{CuSO4}}=\dfrac{8}{160}=0,05\left(mol\right)\)
Khối lượng của kali hidroxit
C0/0KOH= \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{4,2.100}{100}=4,2\left(g\right)\)
Số mol của kali hidroxit
nKOH = \(\dfrac{m_{KOH}}{M_{KOH}}=\dfrac{4,2}{56}=0,075\left(mol\right)\)
Pt : CuSO4 + 2KOH → Cu(OH)2 + K2SO4\(|\)
1 2 1 1
0,05 0,075 0,0375 0,0375
a) Lập tỉ số so sánh : \(\dfrac{0,05}{1}>\dfrac{0,075}{2}\)
⇒ CuSO4 dư . KOH phản ứng hết
⇒ Tính toán dựa vào số mol của KOH
Số mol của đồng(II) hidroxit
nCu(OH)2 = \(\dfrac{0,075.1}{2}=0,0375\left(mol\right)\)
Khối lượng của đồng (II) hidroxit
mCu(OH)2 = nCu(OH)2 . MCu(OH)2
= 0,0375 . 98
= 3,675 (g)
b) Số mol của kali sunfat
nK2SO4 = \(\dfrac{0,0375.1}{1}=0,0375\left(mol\right)\)
Khối lượng của natri sunfat
mK2SO4 = nK2SO4 . MK2SO4
= 0,0375 . 174
= 6,525 (g)
Số mol dư của dung dịch đồng (II) sunfat
ndư = nban đầu- nmol
= 0,05 - (\(\dfrac{0,075.1}{2}\))
= 0,0125 (mol)
Khối lượng dư của dung dịch đồng (II) sunfat
mdư = ndư . MCuSO4
= 0,0125 . 160
= 2 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mCuSO4 + mKOH - mCu(OH)2
= 50 + 100 - 3,675
= 146,325 (g)
Nồng độ phần trăm của natri sunfat
C0/0K2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{6,525.100}{146,325}=4,46\)0/0
Nồng độ phần trăm của dung dịch đồng (II) sunfat
C0/0CuSO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{2.100}{146,325}=1,37\)0/0
Chúc bạn học tốt
\(n_{HCl}=2.0,2=0,4\left(mol\right)\) ; \(n_{NaOH}=\dfrac{8\%.100}{100\%.40}=0,2\left(mol\right)\)
Pt : \(HCl+NaOH\rightarrow NaCl+H_2O\)
a) Xét tỉ lệ : \(0,4>0,2\Rightarrow HCldư\)
Dung dịch X gồm : NaCl , HCl dư
Cho quỳ tím vào X --> Quỳ tím hóa đỏ (do HCl có tính axit)
b) \(n_{NaOH\left(pư\right)}=n_{NaCl}=0,2\left(mol\right)\)
\(m_{Rắn.khan}=m_{NaCl}=0,2.58,5=11,7\left(g\right)\)