Tính pH của dung dịch thu được khi trộn lẫn 100 mL KH2PO4 , 0,1M với 50 ml dung dịch K2HPO4, 0,4M để tạo thành dung dịch đệm phosphate. Biết H3PO4 có pk1 =2,18: pKa2 = 7,12 : pKa3 = 12,3.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án A
Phản ứng: KOH + HCl → KCl + H2O
Có nKOH = 0,02 mol; nHCl = 0,01 mol
⇒ sau phản ứng thu được 200 ml dung dịch X gồm 0,01 mol KCl
và 0,01 mol KOH → dung dịch X có môi trường bazơ.
pH = 14 + log([OH−]) = 14 + log(0,01 ÷ 0,2) = 12,7 → chọn đáp án A.

Chọn đáp án A
Phản ứng: KOH + HCl → KCl + H2O
Có nKOH = 0,02 mol; nHCl = 0,01 mol
⇒ sau phản ứng thu được 200 ml dung dịch X gồm 0,01 mol KCl
và 0,01 mol KOH → dung dịch X có môi trường bazơ.
pH = 14 + log([OH-]) = 14 + log(0,01 ÷ 0,2) = 12,7 → chọn đáp án A

Đáp án B
Hướng dẫn giải:
H3PO4 + 2KOH → K2HPO4+ 2H2O
x 2x x mol
H3PO4 + 3KOH → K3PO4 + 3H2O
y 3y y mol
Ta có: nKOH= 2x + 3y= 0,1.2= 0,2 mol
mhỗn hợp muối= 174x + 212 y= 14,95 gam
Giải hệ trên ta có: x= 0,025 mol; y = 0,05 mol → nH3PO4= x+y= 0,075 mol
→ mH3PO4= 0,075. 98= 7,35 gam → mdung dịch H3PO4 35%= 7,35.100/35= 21 (gam)
→Vdd = m/D= 21/1,25= 16,8 ml
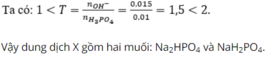

So tính axit của \(H_2PO_4^-\) và \(HPO_4^{2-}\)
\(\left(1\right)H_2PO_4^-⇌H^++HPO_4^{2-}\) \(pKa_2=7,12\)
\(\left(2\right)HPO_4^{3-}⇌H^++PO_4^{3-}\) \(pKa_3=12,3\)
Ta thấy PT (1) có xu hướng xảy ra hơn PT (2) => \(HPO_4^{3-}\) có xu hướng tạo ra \(OH^-\)
=> Xét \(H_2PO_4^-\) là axit, \(HPO_4^{3-}\) là base
\(CM_{KH_2PO_4.mới}=\dfrac{0,1.0,1}{0,1+0,05}=\dfrac{1}{15}M\)
\(CM_{K_2HPO_4.mới}=\dfrac{0,05.0,4}{0,1+0,05}=\dfrac{2}{15}M\)
CT tính ph dd đệm: \(ph=pK_{HA}+log\dfrac{C_B}{C_A}\)
\(\Rightarrow ph=7,12+log\dfrac{\dfrac{2}{15}}{\dfrac{1}{15}}=7,42\)
Em cảm ơn ạ