Cho 6,5g kẽm vào 200ml dung dịch axit sunfuric loãng 1M
a.Hỏi có chất nào dư sau phản ứng?
b.Thu được bao nhiêu gam muối
c. Tính CM của các chất trong dung dịch sau phản ứng. Biết V không đổi
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
a) Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{H_2SO_4}=\dfrac{200\cdot4,9\%}{98}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Cả 2 chất p/ứ hết
b+c) Theo PTHH: \(n_{ZnSO_4}=n_{H_2}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnSO_4}=0,1\cdot161=16,1\left(g\right)\\m_{H_2}=0,1\cdot2=0,2\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Zn}+m_{ddH_2SO_4}-m_{H_2}=206,3\left(g\right)\)
\(\Rightarrow C\%_{ZnSO_4}=\dfrac{16,1}{206,3}\cdot100\%\approx7,8\%\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(m_{FeSO_4}=\dfrac{200\cdot15,2}{100}=30,4g\Rightarrow n_{FeSO_4}=0,2mol\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,1 0,2
\(\Rightarrow\) Zn hết, H2SO4 dư 0,1mol.
a, Có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(m_{FeSO_4}=200.15,2\%=30,4\left(g\right)\Rightarrow n_{FeSO_4}=\dfrac{30,4}{152}=0,2\left(mol\right)\)
PT: \(Zn+FeSO_4\rightarrow ZnSO_4+Fe\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\), ta được FeSO4 dư, Zn hết.
b, Theo PT: \(n_{ZnSO_4}=n_{Fe}=n_{FeSO_4Z\left(pư\right)}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow n_{FeSO_4\left(dư\right)}=0,1\left(mol\right)\)
Có: m dd sau pư = 6,5 + 200 - 0,1.56 = 200,9 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{ZnSO_4}=\dfrac{0,1.161}{200,9}.100\%\approx8,01\%\\C\%_{FeSO_4\left(dư\right)}=\dfrac{0,1.152}{200,9}.100\%\approx7,57\%\end{matrix}\right.\)
Bạn tham khảo nhé!

1.
nAl=\(\dfrac{5,4}{27}\)=0,2 mol
mHCl=\(\dfrac{175.14,6}{100}\)=25,55g
nHCl=\(\dfrac{25,55}{36,5}\)=0,7
2Al + 6HCl → 2AlCl3 + 3H2↑
n trước pứ 0,2 0,7
n pứ 0,2 →0,6 → 0,2 → 0,3 mol
n sau pứ hết dư 0,1
Sau pứ HCl dư.
mHCl (dư)= 36,5.0,1=3,65g
mcác chất sau pư= 5,4 +175 - 0,3.2= 179,8g
mAlCl3= 133,5.0,2=26,7g
C%ddHCl (dư)= \(\dfrac{3,65.100}{179,8}=2,03%\)%
C%ddAlCl3 = \(\dfrac{26,7.100}{179,8}\)= 14,85%
2.
200ml= 0,2l
mMg= \(\dfrac{4,2}{24}=0,175mol\)
Mg + 2HCl → MgCl2 + H2↑
0,175→ 0,35 → 0,175→0,175 mol
a) VH2= 0,175.22,4=3,92l.
b)C%dHCl= \(\dfrac{0,35}{0,2}=1,75\)M

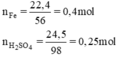
Phương trình hóa học của phản ứng:

So sánh tỉ lệ 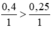 ⇒ Fe dư
⇒ Fe dư
Theo PT nFe (pư) = nH2SO4 = 0,25 mol ⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15. 56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25 . 22,4 = 5,6l.

a) nFe= 16/56 =~ 0,3 mol
mH2S04 =( C% .mdd ) /100%= ( 20.100) /100 = 20g
nH2SO4 = 20/98 =~ 0,2mol
lập pthh của pu
Fe + H2SO4 ----------> FeSO4 + H2
1mol 1mol 1mol 1mol
0,3mol 0,2mol
xét tỉ lệ nFe dư sau pư vậy tính theo mol H2SO4
nFe (pư) = (0,2 .1 )/1 =0,2mol
nFe (dư) = 0,3 -0,2 =0,1mol
mFe dư = 0,1 . 56 = 5,6 g
mFeSO4 = 0,2 .152 = 30,4 g
b) mdd sau pư = mFe + m dung môi = 16 +100=116 g
c% Fe = (5,6 / 116) .100%=~ 4,83%
c% FeSO4 =(30,4/116).100%=~ 26,21%
a) đối 200ml =0,2 lít
CMFe =n/v = 0,1 / 0,2 =0,5 mol/lít
CMFeSO4 =n/v = 0,2/0,2=1 mol /lít
a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(n_{H_2SO_4}=1.0,2=0,2\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\) => Zn hết, H2SO4 dư
b)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
0,1--->0,1------->0,1
=> \(m_{ZnSO_4}=0,1.161=16,1\left(g\right)\)
c) \(\left\{{}\begin{matrix}C_{M\left(H_2SO_4.dư\right)}=\dfrac{0,2-0,1}{0,2}=0,5M\\C_{M\left(ZnSO_4\right)}=\dfrac{0,1}{0,2}=0,5M\end{matrix}\right.\)