1a. Vì sao hidro được coi là nhiên liệu sạch. b. viết các phương trình hóa học điều chế hidro trong phòng thí nghiệm và trong công nghiệp?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Những câu hỏi này là kiến thức cơ bản trong sách giáo khoa em nhé. Em chịu khó lấy sách ra đọc nha, khi nào mà không hiểu thì em có thể hỏi chị nha!

2Al + 6HCl --> 2AlCl3 + 3H2
Fe + 2HCl --> FeCl2 + H2
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
Fe + H2SO4 --> FeSO4 + H2

a.
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
b.
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Thêm đk H2SO4 loãng chứ đặc nóng có thể giải phóng H2S, SO2,...

Bài 1 : a , c
Bài 2 :
2Mg + O2 -to-> 2MgO => Hóa hợp
2KMnO4 -to-> K2MnO4 + MnO2 + O2 => Phân hủy
Fe + CuCl2 => FeCl2 + Cu => Thế
Bài 3 :
- Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để vị trí ống nghiệm nằm thẳng đứng, miệng ống nghiệm hướng lên trên vì trọng lượng khí oxi (32g) lớn hơn trọng lượng không khí (29g).
- Đối với khí hiđro thì không thể được vì trọng lượng khí hiđro rất nhẹ (2g) so với không khí (29g). Đối với khí H2 thì phải đặt ống nghiệm thẳng đứng và miệng ống nghiệm hướng xuống dưới.
Bài 5 :
nFe = 22.4/56 = 0.4 (mol)
nH2SO4 = 24.5/98 = 0.25 (mol)
Fe + H2SO4 => FeSO4 + H2
0.25__0.25____________0.25
mH2SO4 (dư) = ( 0.4 - 0.25) * 98 = 14.7(g)
VH2 = 0.25*22.4 = 5.6(l)
Bài 1: a,c
Bài 2:
a) \(2Mg+O_2\rightarrow2MgO\)
=> Phản ứng hóa hợp
b) \(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
=> Phản ứng phân hủy
c) \(Fe+CuCl_2\rightarrow FeCl_2+Cu\)
=> Phản ứng thế
Bài 3:
- Phải để vị trí ống nghiệm nằm thẳng đứng, miệng hướng lên trên ( Vì khó oxi nặng hơn không khí)
- Đối với khí hidro, không làm thế được vì khí hidro rất nhẹ so với không khí=> phải đặt ống nghiệm thẳng đứng và miệng ống hướng xuống dưới.
Bài 5:
a) Ta có:
\(n_{Fe}=\dfrac{m}{M}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{m}{M}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
Pt phản ứng: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2^{\uparrow}\)
Ta lập tỉ lệ: \(\dfrac{n_{Fe}}{h\text{ệ}s\text{ố}c\text{â}n=}=\dfrac{0,4}{1}=0,4\)
\(\dfrac{n_{H_2SO_4}}{h\text{ệ}s\text{ố}c\text{â}n=}=\dfrac{0,25}{1}=0,25\)
Ta thấy: 0,4>0,25 => Fe còn dư và H2SO4 phản ứng hết.
Theo pt phản ứng, ta có:
\(n_{Fe\left(p\text{ứ}\right)}=\dfrac{1}{1}n_{H_2SO_4}=\dfrac{1}{1}.0,25=0,25\left(mol\right)\)
\(\Rightarrow n_{Fe\left(d\text{ư}\right)}=n_{Fe\left(ban\text{đ}\text{ầu}\right)}-n_{Fe\left(p\text{ứ}\right)}=0,4-0,25=0,15\left(mol\right)\)
\(\Rightarrow m_{Fe\left(d\text{ư}\right)}=n.M=0,15.56=8,4\left(g\right)\)
Vậy Fe dư và dư 8,4g
b) The ptpu ta có:
\(n_{H_2}=\dfrac{1}{1}n_{H_2SO_4}=\dfrac{1}{1}.0,25=0,25\left(mol\right)\)
\(\Rightarrow V_{H_2\left(\text{đ}ktc\right)}=n.22,4=0,25.22,4=5,6\left(l\right)\)

Điều chế oxi:
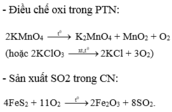
- Trong phòng thí nghiệm, oxi được điều chế bằng cách phân hủy những hợp chất giàu Oxi và ít bên với nhiệt như KMnO4, KClO3, ...
2KMnO4 → K2MnO4 + MnO2 + O2
2KClO3 → 2KCl + 3O2
- Trong công nghiệp:
a) Từ không khí: Không khí sau khi đã loại bỏ hết hơi nước, khí CO2, được hóa lỏng dưới áp suất 200 atm đồng thời hạ thấp nhiệt độ. Chưng cất phân đoạn không khí lỏng, thu được oxi lỏng. Oxi lỏng được vận chuyển trong những bình thép có thể tích 100 lít dưới áp suất 150atm.
b) Từ nước. Điện phân nước: 2H2O
Người ta không áp dụng phương pháp phòng thí nghiệm cho phòng thí nghiệm vì trong phòng thí nghiệm chỉ điều chế lượng nhỏ oxi, còn công nghiệp cần một lượng lớn giá thảnh rẻ.

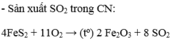
a) Khi đốt cháy hidro sinh ra phản ứng
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
Đây là phản ứng tỏa nhiều nhiệt, nước sinh ra vô hại. Do đó, hidro được coi là nguyên liệu sạch
b)
Trong phòng thí nghiệm :
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\)
Trong công nghiệp :
\(2H_2O \xrightarrow{điện\ phân} 2H_2 + O_2\)
a. H2 là nhiên liệu sạch vì khi đốt không thải ra khí hại mà tạo ra hơi nước (cần thiết cho môi trường)
b. Điều chế H2:
*Trong phòng thí nghiệm: Cho 1 số kim loại (ví dụ Zn, Fe, Mg, ...) tác dụng với axit (HCl, H2SO4, ...)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
*Trong công nghiệp: Điện phân nước: \(2H_2O\underrightarrow{\text{điện phân}}2H_2+O_2\)