Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mFe = 1000 x 95 / 100 = 950kg
Phương trình phản ứng:
Fe2O3 + 3CO → 2Fe + 3CO2(to cao)
160kg Fe2O3 tạo ra 2 x 56kg Fe
x kg Fe2O3 tạo ra 950 kg Fe
x = 160 x 950 / 112 = 1357,14kg
Khối lượng Fe2O3 cần dùng: 1357,14 x 100 / 80 = 1606,425kg
Khối lượng quặng hematit chứa 60% Fe2O3 cần dùng:
1696,425 x 100 /60 ≈ 2827,375kg.

Khối lượng Fe có trong gang là mFe = 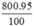 = 760 (tấn)
= 760 (tấn)
Khối lượng sắt thực tế cần để sản xuất gang (bị hao hụt 1%)
mFe = 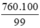 = 767,68 (tấn)
= 767,68 (tấn)
Fe3O4 + 4C → 4CO + 3Fe
232 3.56
x = ? 767,68 (tấn)
Khối lượng Fe3O4 là mFe3O4 = 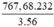 = 1060,13 (tấn)
= 1060,13 (tấn)
Khối lượng quặng manhetit là m = 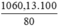 = 1325,163 (tấn)
= 1325,163 (tấn)

PTHH: \(Fe_2O_3+3CO\xrightarrow[]{t^o}2Fe+3CO_2\uparrow\)
Đổi 1 tấn = 1000 kg
Ta có: \(n_{Fe}=\dfrac{1000\cdot98\%}{56}=17,5\left(kmol\right)\)
\(\Rightarrow n_{CO}=26,25\left(kmol\right)\) \(\Rightarrow V_{CO}=26,25\cdot22,4=588\left(m^3\right)\)

a. nH2 = nFe = 0,1mol
Bảo toàn nguyên tố Fe => nFe2O3 = 0,05mol
=> mFe2O3 = 8g
=> %Fe2O3 = (8:10) . 100% = 80%

Khối lượng sắt có trong tấn gang chứa 95% sắt là : (tấn).
Khối lượng sắt thực tế cần phải có là : (tấn).
Fe3O4 -> 3Fe
232 tấn 3.56= 168 tấn
Muốn có 767,68 tấn sắt, cần : (tấn)Fe3O4
Khối lượng quặng manhetit cần dùng là : (tấn).

\(m_{Fe}=0.95\left(tấn\right)=0.95\cdot10^3\left(kg\right)\)
\(\Rightarrow n_{Fe}=\dfrac{0.95\cdot10^3}{56}=\dfrac{19}{1120}\cdot10^3\left(kmol\right)\)
\(\Rightarrow n_{Fe_2O_3}=\dfrac{1}{2}\cdot\dfrac{19}{1120}\cdot10^3\left(kmol\right)\)
\(m_{Fe_2O_3}=\dfrac{19}{2240}\cdot10^3\cdot160=1357.1\left(kg\right)\)
\(\Rightarrow m_{quặng}=\dfrac{1357.1}{60\%}=2261.9\left(kg\right)\)
\(A\)


chứa 5% tạp chất hay 5% Fe2O3 nhỉ?
Là 5%C đấy bạn