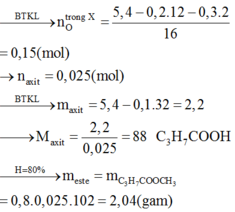
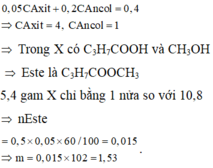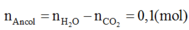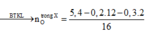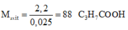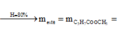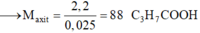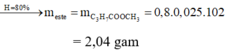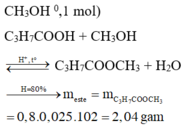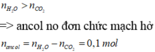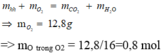Đốt cháy hoàn toàn 10,8 gam hỗn hợp X gồm một axit cacboxylic no, đơn chức và một ancol đơn chức, sau phản ứng thu được 0,4 mol CO2 và 0,6 mol H2O. Thực hiện phản ứng este hóa 5,4 gam X với hiệu suất 60% thu được m gam este. Giá trị của m là
A. 1,53.
B. 3,06.
C. 4,25.
D. 8,5.