đủ vCho 8,3 gam hỗn hợp Fe và Al phản ứng vừaới dung dịch H2SO4 20% thu được dung dịch A và 5,6 lít (đktc). Khối lượng dung dịch A là
A. 130 gam
B. 130,3 gam
C. 130,6 gam
D. 130,4 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2Al+6HCl->2AlCl_3+3H_2\\ Fe+2HCl->FeCl_2+H_2\\ n_{Al}=a;n_{Fe}=b\\ 27a+56b=8,3\\ 1,5a+b=\dfrac{5,6}{22,4}=0,25\\ a=b=0,1\\ m_{Al}=27\cdot0,1=2,7g\\ m_{Fe}=8,3-2,7=5,6g\\ a=\dfrac{3a+2b}{500}\cdot36,5=3,65\%\\ m_{ddsau}=508,3-0,25\cdot2=507,8g\\ C\%_{AlCl_3}=\dfrac{133,5a}{507,8}=2,63\%\\ C\%_{FeCl_2}=\dfrac{127b}{507,8}=2,50\%\)

Gọi a,b lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu
=> 27a+56b=8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25mol\)
Ta có quá trình trao đổi elcetron
\(Al^0\rightarrow Al^{+3}+3e\)
a----------------3a--(mol)
\(Fe^0\rightarrow Fe^{+2}+2e\)
b----------------2b--(mol)
\(2H^{-1}+2e\rightarrow H_2^0\)
----------0,5------0,25-(mol)
Áp dụng định luật bảo toàn e ta có: 3a+2b=0,5 (2)
Giải hệ phương trình gồm (1) và (2) ta được: \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\left[{}\begin{matrix}m_{Al}=0,1\cdot27=2,7g\\m_{Fe}=0,1\cdot56=5,6g\end{matrix}\right.\)

\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Gọi x, y lần lượt là số mol Al, Fe
Theo đề bài ta có hệ pt
\(\left\{{}\begin{matrix}27x+56y=8,3\\\dfrac{3}{2}x+y=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
a)\(x=\dfrac{\dfrac{0,1.3}{2}+0,1}{0,2}=0,25M\)
b)\(\%m_{Al_2(SO_4)_3}=\dfrac{\dfrac{0,1}{2}.342}{\dfrac{0,1}{2}.342+0,1.152}.100=52,94\%\)
=> %mFeSO4=100-52,94=47,06%
c)\(CM_{Al_2(SO_4)_3}=\dfrac{0,05}{0,2}=0,25M\)
\(CM_{FeSO_4}=\dfrac{0,1}{0,2}=0,5M\)
d) 1> Thu được kết tủa bé nhất
-TH1 : Lượng KOH chỉ phản ứng với FeSO4 tạo kết tủa, không đủ để tạo kết tủa với Al2(SO4)3
\(2KOH+FeSO_4\rightarrow Fe\left(OH\right)_2+K_2SO_4\)
=> \(m_{ddKOH}=\dfrac{0,1.2.56}{15\%}=74,67\left(g\right)\)
TH2: Lượng KOH phản ứng với FeSO4 tạo kết tủa và tạo kết tủa với Al2(SO4)3 sau đó tan kết tủa của Al2(SO4)3
\(2KOH+FeSO_4\rightarrow K_2SO_4+Fe\left(OH\right)_2\)
\(6KOH+Al_2(SO_4)_3\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
\(Al\left(OH\right)_3+KOH\rightarrow KAlO_2+2H_2O\)
=>\(m_{ddKOH}=\dfrac{\left(0.1.2+0,05.6+0,1\right).56}{15\%}=224\left(g\right)\)
2> Thu được kết tủa lớn nhất :
Lượng KOH phản ứng với FeSO4 tạo kết tủa và tạo kết tủa với Al2(SO4)3 và không tan kết tủa của Al2(SO4)3
\(2KOH+FeSO_4\rightarrow K_2SO_4+Fe\left(OH\right)_2\)
\(6KOH+Al_2(SO_4)_3\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
=>\(m_{ddKOH}=\dfrac{\left(0.1.2+0,05.6\right).56}{15\%}=186,67\left(g\right)\)
Đặt \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
\(PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\left(mol\right)\) \(a\) \(1,5a\) \(0,5a\) \(1,5a\)
\(PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\left(mol\right)\) \(b\) \(b\) \(b\) \(b\)
Ta có hpt: \(\left\{{}\begin{matrix}27a+56b=8,3\\1,5a+b=\dfrac{5,6}{22,4}\end{matrix}\right.\Leftrightarrow a=b=0,1\left(mol\right)\)
\(a.x=\dfrac{1,5a+b}{0,2}=\dfrac{0,15+0,1}{0,2}=1,25\left(M\right)\\ b.\%m_{Al}=\dfrac{27.0,1}{8,3}.100=32,53\left(\%\right)\\ \%m_{Fe}=100-32,53=67,47\left(\%\right)\\ c.C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,5a}{0,2}=0,25\left(M\right)\\ C_{M_{FeSO_4}}=\dfrac{b}{0,2}=0,5\left(M\right)\\ d.\)
\(PTHH:Al_2\left(SO_4\right)_3+6KOH\rightarrow3K_2SO_4+2Al\left(OH\right)_3\)
\(\left(mol\right)\) \(0,05\) \(0,3\) \(0,1\)
\(PTHH:FeSO_4+2KOH\rightarrow Fe\left(OH\right)_2+K_2SO_4\)
\(\left(mol\right)\) \(0,1\) \(0,2\)
\(PTHH:Al\left(OH\right)_3+KOH\rightarrow KAlO_2+2H_2O\)
\(\left(mol\right)\) \(0,1\) \(0,1\)
\(d.1.\) Lượng kết tủa bé nhất khi kết tủa \(Al\left(OH\right)_3\) sinh ra tan hết trong dd KOH
Khi đó: \(n_{KOH}=0,6\left(mol\right)\rightarrow m_{ddKOH}=\dfrac{0,6.100.56}{15}=224\left(g\right)\)
\(d.2.\) Lượng kết tủa lớn nhất khi KOH tác dụng vừa đủ với dd A
Khi đó: \(n_{KOH}=0,5\left(mol\right)\rightarrow m_{ddKOH}=\dfrac{0,5.56.100}{15}=186,67\left(g\right)\)

Gọi x và y lần lượt là số mol Fe và Al tham gia phản ứng
a/PTHH: Fe + H2SO4 -----> FeSO4 + H2
(mol) x x x x
PTHH: 2Al + 3H2SO4 -----> Al2(SO4)3 + 3H2
(mol) y 3y/2 y/2 3y/2
Suy ra hệ : \(\begin{cases}152x+\frac{342y}{2}=81,7\\56x+27y=19,3\end{cases}\) \(\Leftrightarrow\begin{cases}x=0,2\\y=0,3\end{cases}\)
=> mFe = 0,2.56 = 11,2 (g)
\(\Rightarrow\%Fe=\frac{11,2}{19,3}.100\approx58,03\%\)
%Al = 100% - 58,03% = 41,97%
b/ nH2 = x+3y/2 = 0,2 + 3.0,3/2 = 0,65 (mol)
=> VH2 = 22,4.0,65 = 14,56 (l)
c/ nH2SO4 = x+3y/2 = 0,65 (mol)
=> mH2SO4 = 98.0,65 = 63,7 (g)

Đáp án A
Số mol H 2 thu được là: n H 2 = 2 , 24 22 , 4 = 0 , 1 mol
Sơ đồ phản ứng hóa học:


Đáp án D
Trong dung dịch axit, ta có :
n Cl - = n HCl = 0 , 3 mol
n SO 4 2 - = n H 2 SO 4 = 0 , 15 mol
Sơ đồ phản ứng :

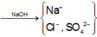
Cho NaOH vào X để thu được kết tủa lớn nhất thì dung dịch sau phản ứng chỉ còn các ion Na + , Cl - và SO 4 2 - .
Áp dụng bảo toàn điện tích trong dung dịch sau phản ứng và bảo toàn nguyên tố Na, ta có :
n NaOH = n Na + = n Cl - + 2 n SO 4 2 - = 0,6 mol
→ V dd NaOH 1 M = 0,6 lit = 600ml
Đáp án B
Bảo toàn nguyên tố Hidro: nH2SO4 = nH2 = 0,25 mol
⇒ mdung dịch H2SO4 = 0,25 × 98 ÷ 0,2 = 122,5(g).
Bảo toàn khối lượng: mdung dịch A = 8,3 + 122,5 – 0,25 × 2 = 130,3(g)