Một học sinh làm thí nghiệm điều chế NH3 bằng cách đun nóng NH4Cl với Ca(OH)2, khí NH3 sinh ra thường có lẫn hơi nước. Vậy để làm khô khí NH3 cần dùng hóa chất nào sau đây?
A. NaCl (rắn)
B. dung dịch H2SO4 đặc
C. CuSO4 (rắn)
D. CaO (rắn)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Nguyên tắc làm khô là có khả năng hút nước và không tác dụng được với chất cần làm khô.
NH3 có tính bazo → không dùng được H2SO4 đặc.
NH3 có tính khử, có khả năng tác dụng với các cation kim loại tạo các hidroxit kết tủa→ không dùng được CuSO4.
NaCl rắn không có khả năng hấp thụ nước → loại
→ Dùng CaO rắn.

Chọn đáp án D
(2) Sai vì NH3 có thể tác dụng H2SO4 ⇒ mất khí cần làm khô.
(3) Sai vì NH3 làm quỳ ẩm hóa xanh.
⇒ Chọn D

Chọn đáp án D
(2) Sai vì NH3 có thể tác dụng H2SO4 ⇒ mất khí cần làm khô.
(3) Sai vì NH3 làm quỳ ẩm hóa xanh.
⇒ Chọn D

Câu 29. Chất có thể dùng chất nào sau đây để làm khô khí NH3?
A. H2SO4 đặc.
B. P2O5.
B. CuSO4 khan.
D. KOH rắn.
Câu 30. **Nêu hiện tượng và giải thích bằng phương trình hóa học khi cho từ từ đến dư dung dịch NH3 vào dung dịch ZnCl2?
- Ban đầu xuất hiện kết tủa trắng:
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2 ↓ + 2NH4Cl
- Sau đó, kết tủa tan dần đến hết:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
Vậy hiện tượng của thí nghiệm là: Thấy xuất hiện kết tủa trắng, kết tủa tan dần khi cho dư NH3.
Câu 31. Khi dẫn khí NH3 đi qua ống đựng bột CuO nung nóng thì xảy ra pư: 2NH3 + 3CuO → N2 + 3H2O + 3Cu. Dùng 4,48 lít khí NH3 (đkc) sẽ khử được bao nhiêu gam CuO?
\(n_{CuO}=\dfrac{3}{2}n_{NH_3}=0,3\left(mol\right)\)
=> \(m_{CuO}=0,3.80=24\left(g\right)\)
Câu 32. Thêm NH3 đến dư vào dung dịch hỗn hợp chứa 0,01 mol FeCl3 ; 0,2 mol MgCl2. Sau khi phản ứng xảy ra hoàn toàn, lượng kết tủa thu được là bao nhiêu gam?
FeCl3, CuCl2 \(\underrightarrow{ddNH_3\left(dư\right)}\) Fe(OH)3
Do Cu(OH)2 sinh ra tạo phức hết với dung dịch NH3
=> mkết tủa = \(m_{Fe\left(OH\right)_3}\)
FeCl3 + 3NH3+ 3H2O \(\rightarrow\) Fe(OH)3 + 3NH4Cl
0,01----------------------------->0,01
=> \(m_{Fe\left(OH\right)_3}\)= 107.0,01=1,07 gam
Câu 33. Cho lượng dư khí ammoniac đi từ từ qua ống sứ chứa 3,2 g CuO nung nóng đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn A và một hỗn hợp khí. Chất rắn A phản ứng vừa đủ với 20 ml dung dịch HCl 1M. Thể tích nitơ ( đktc) được tạo thành sau phản ứng là giá trị nào sau đây?
Ta có : nCuO ban đầu= 0,04 mol ; nHCl= 0,02 mol
2NH3+ 3CuO ----to---> N2+ 3Cu + 3H2O (1)
CuO + 2HCl → CuCl2+ H2O (2)
Theo PT (2) nCuO PT2= \(\dfrac{1}{2}\).nHCl= 0,01 mol
→nCuO PT 1= nCuO- nCuO PT2= 0,04-0,01=0,03 mol
→ nN2=\(\dfrac{1}{3}\).nCuO PT1= 0,01 mol
→ VN2=0,224 lít

Đáp án B
Khí NH3 nhẹ hơn không khí nên không thể thu khí như hình 2 (vì khí NH3 sẽ bay lên hết).
Khí NH3 tan nhiều trong nước nên cũng không thể thu khí bằng phương pháp đẩy nước như hình 3 và 4.
Chỉ có hình 1 biểu diễn đúng cách điều chế khí NH3 trong phòng thí nghiệm.
![]()

Khí NH3 nhẹ hơn không khí nên không thể thu khí như hình 2 (vì khí NH3 sẽ bay lên hết).
Khí NH3 tan nhiều trong nước nên cũng không thể thu khí bằng phương pháp đẩy nước như hình 3 và 4
Chỉ có hình 1 biểu diễn đúng cách điều chế khí NH3 trong phòng thí nghiệm.
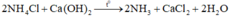
=> Chọn đáp án A.

Do NH3 nhẹ hơn không khí và tan tốt trong nước nên phương pháp thu khí NH3 tốt nhất là bình úp ngược trong không khí
=>Hình 1
=>A

Chọn A.
NH3 tan trong nước nên không thể thu khí bằng phương pháp đẩy nước → Loại hình 3 và 4
NH3 nhẹ hơn không khí → không thu khí bằng cách để miệng ống nghiệm lên trên → Loại hình 2
Đáp án D
Nguyên tắc làm khô là có khả năng hút nước và không tác dụng được với chất cần làm khô.
NH3 có tính bazo → không dùng được H2SO4 đặc.
NH3 có tính khử, có khả năng tác dụng với các cation kim loại tạo các hidroxit kết tủa→ không dùng được CuSO4.
NaCl rắn không có khả năng hấp thụ nước → loại
→ Dùng CaO rắn