Hòa tan hoàn toàn 0,1 mol FeS2 trong 200 ml dung dịch HNO3 4M, sản phẩm thu được gồm dung dịch X và một chất khí thoát ra. Dung dịch X có thể hòa tan tối đa m gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 đều là NO. Giá trị của m là :
A. 12,8.
B. 6,4
C. 9,6.
D. 3,2


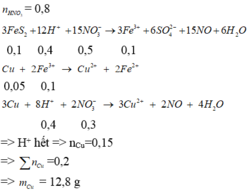

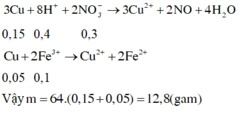
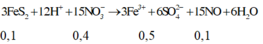
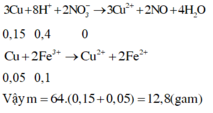
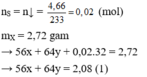
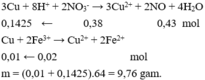
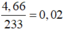
Đáp án A
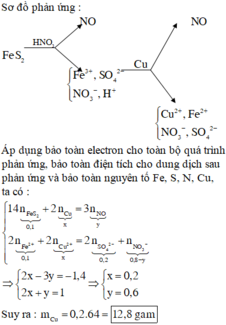
Sơ đồ phản ứng :
Áp dụng bảo toàn electron cho toàn bộ quá trình phản ứng, bảo toàn điện tích cho dung dịch sau phản ứng và bảo toàn nguyên tố Fe, S, N, Cu, ta có :