Zn+CuSo4 Tại sao kim loại lại giảm khối lượng so với ban đầu ạ Đồng sinh ra bấm vào thanh kẽm mà sao lại khẳng định được khối lượng giảm ạ. Nguyên lí như nào ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a.Zn+CuSO_4->ZnSO_4+Cu\)
b. m Zn giảm vì sau phản ứng tạo Cu (M = 64), M(Cu) < M(Zn) = 65 nên khối lượng lá Zn tăng.
\(m_{Zn\left(Pư\right)}=65x\left(g\right)\\ m_{Cu}=64x\left(g\right)\\c.\Delta m_{rắn}=25-24,96=65x-64x\\ x=0,04mol\\ m_{Zn\left(Pư\right)}=65x=2,6g< 25g\Rightarrow Zn:hết\\d. n_{CuSO_4}=160x=6,4g\)

Tham khảo
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)

Đáp án : D
Zn + Cu2+ -> Zn2+ + Cu
=> mgiảm = (65 – 64)x = 0,1g
=> x = 0,1 mol = nZn pứ
=> mZn pứ = 6,5g

Giải thích: Đáp án D
Zn + Cu2+ -> Zn2+ + Cu
=> mgiảm = (65 – 64)x = 0,1g
=> x = 0,1 mol = nZn pứ
=> mZn pứ = 6,5g

Đáp án C
Phương trình phản ứng:
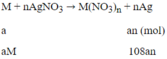
Khối lượng thanh thứ nhất tăng 151%:
108an - aM = 1,51 (1)

Khối lượng thanh thứ 2 giảm:
aM - 32an = 0,01 (2)
Tổ hợp (1) và (2) ta được: aM = 0,65; an = 0,02
⇒ Chọn M = 32,5n
Khi n = 2 thì M = 65
Vậy M =Zn

với dạng bài này thì zn luôn dư
Đặt : nZn(ban đầu) = a (mol),nCuSO4 = b (mol) (a>b)
PTHH : Zn + CuSO4 ---> ZnSO4 + Cu
b<----- b --------> b --------> b (mol)
nzn chưa pứ = nzn ban đầu - npứ = a - b (mol)
Ta có : m(thanh kẽm lúc sau) = mCu(sinh ra) + mkẽm chưa pứ
= 64b + 65 (a-b)
= 65a - b (gam) < 65a = mzn ban đầu
=> khẳng định được khối lượng thanh kẽm giảm (chính xác hơn là giảm b gam)
=
với dạng bài này thì zn luôn dư
Đặt : nZn(ban đầu) = a (mol),nCuSO4 = b (mol) (a>b)
PTHH : Zn + CuSO4 ---> ZnSO4 + Cu
b<----- b --------> b --------> b (mol)
nzn chưa pứ = nzn ban đầu - npứ = a - b (mol)
Ta có : m(thanh kẽm lúc sau) = mCu(sinh ra) + mkẽm chưa pứ
= 64b + 65 (a-b)
= 65a - b (gam) < 65a = mzn ban đầu
=> khẳng định được khối lượng thanh kẽm giảm (chính xác hơn là giảm b gam)