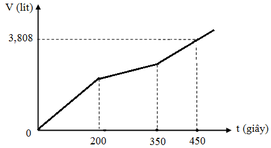
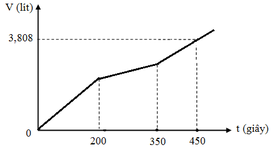
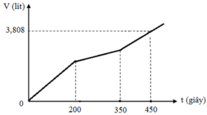
Hòa tan m gam hỗn hợp CuSO4 và KCl vào nước thu được dung dịch X. Điện phân dung dịch X với cường độ dòng điện không đổi (điện cực trơ, màng ngăn xốp). Thể tích khí (V) thoát ra theo thời gian (t) được biểu diễn theo đồ thị sau:
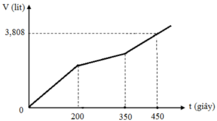
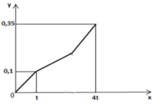
Nếu dừng điện phân ở thời điểm 250 giây thu được dung dịch Y. Nhúng thanh nhôm (dư) vào Y, sau khi phản ứng hoàn toàn, khối lượng dung dịch Y thay đổi như thế nào?
A. Giảm 1,88 gam.
B. Tăng 1,84 gam
C. Giảm 1,84 gam.
D. Tăng 0,04 gam

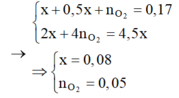
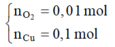
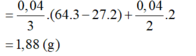


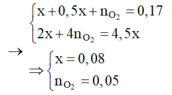
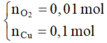
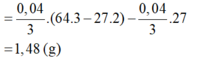




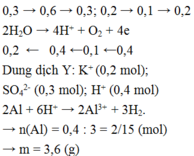

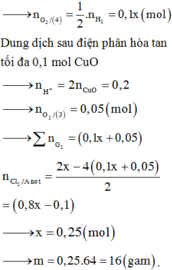
Đáp án A
Tại thời điểm t = 200 (s): chỉ có khí Cl2 (x mol) tại anot Þ ne (1) = 2x mol
Tại thời điểm t = 350 (s): có khí Cl2 (x mol) và O2 Þ ne (2) = 3,5x mol → BT : e nCu = 1,75x
Tại thời điểm t = 450 (s): có khí Cl2 (x mol), O2, H2 Þ ne (3) = 4,5x mol
Tại thời điểm t = 250 (s) Þ ne = 0,2 mol Þ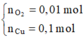
Dung dịch Y có chứa H+ (0,04 mol); Cu2+ (0,04 mol)
Khi cho Y tác dụng với Al thì: mdd giảm