Hỗn hợp X gồm Al, Cr và Na. Chia 16 gam X thành hai phần bằng nhau. Phần 1 tác dụng với nước dư, sau khi các phản ứng xảy ra hoàn toàn, sinh ra 4,48 lít H2 (đktc). Cho phần 2 phản ứng với dung dịch NaOH loãng dư, kết thúc các phản ứng thu được 6,16 lít H2 (đktc). Khối lượng của Cr có trong 16 gam X là
A. 1,65 g.
B. 3,30 g.
C. 5,20 g.
D. 2,60g.

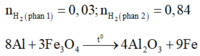


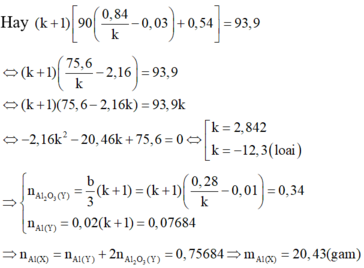



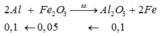
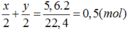
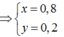

Đáp án B
n H 2 ( 1 ) = 0 , 2 và n H 2 ( 2 ) = 0 , 275
Ta thấy Al tan trong NaOH mà số mol H2 sinh ra lần thứ hai lớn hơn lần thứ nhất nên phần 1 Na hết, Al dư.
Giả sử nNa =x và nAl phản ứng = x (tạo NaAlO2)
Theo định luật bảo toàn mol electron có: