Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với F e 2 O 3 nung nóng.
B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với F e 3 O 4 nung nóng.
D. Al tác dụng với axit H 2 S O 4 đặc nóng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phản ứng nhiệt nhôm là cho nhôm khử các oxit của kim loại => Phản ứng hoá học thuộc loại phản ứng nhiệt nhôm là 1, 4, 5.
Đáp án cần chọn là: C

Đáp án A
Vậy các chất có thể có phản ứng nhiệt nhôm là Fe2O3, Fe3O4, Cr2O3
Còn lại Oxi.

a) nAl=0,2(mol)
PTHH: 2 Al + 6 HCl -> 2 AlCl3 + 3 H2
H2 + CuO -to-> Cu + H2O
nAlCl3= nAl= 0,2(mol)
=> mAlCl3= 133,5. 0,2= 26,7(g)
b) nCu= nH2= 3/2 . 0,2=0,3(mol)
=> mCu= 0,3.64=19,2(g)
(Qua phản ứng nghe kì á, chắc tạo thành chứ ha)
<3

Chọn C.
(1) CaCO3 → t o CaO + CO2
(2) 2AgNO3 + H2O → đpdd 2Ag + 2HNO3 + 1/2O2
(3) 2Al + 3CuO → t o Al2O3 + 3Cu
(4) Cu + 2Fe(NO3)3 ® Cu(NO3)2 + 2Fe(NO3)2
(5) FeCl2 + 3AgNO3 ® Fe(NO3)3 + 2AgCl + Ag
(6) Không xảy ra phản ứng

2 A l + 3 H 2 S O 4 → A l 2 S O 4 3 + 3 H 2
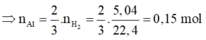
⇒ m F e 2 O 3 (bđ) = 20,05 - 0,15.27 = 16g
⇒ n F e 2 O 3 (bđ) = 16/160 = 0,1 mol
2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Bđ: 015 0,1
Pư: 0,15 0,065
Dư: 0 0,025
⇒ m F e 2 O 3 (dư) = 0,025.160=4g
⇒ Chọn A.

a) PTHH : \(2Al+6HCl-->2AlCl_3+3H_2\) (1)
\(Fe+2HCl-->FeCl_2+H_2\) (2)
\(H_2+CuO-t^o->Cu+H_2O\) (3)
b) Ta có : \(m_{CR\left(giảm\right)}=m_{O\left(lay.di\right)}\)
=> \(m_{O\left(lay.di\right)}=32-26,88=5,12\left(g\right)\)
=> \(n_{O\left(lay.di\right)}=\frac{5,12}{16}=0,32\left(mol\right)\)
Theo pthh (3) : \(n_{H_2\left(pứ\right)}=n_{O\left(lay.di\right)}=0,32\left(mol\right)\)
=> \(tổng.n_{H_2}=\frac{0,32}{80}\cdot100=0,4\left(mol\right)\)
Đặt \(\hept{\begin{cases}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{cases}}\) => \(27a+56b=11\left(I\right)\)
Theo pthh (1) và (2) : \(n_{H_2\left(1\right)}=\frac{3}{2}n_{Al}=\frac{3}{2}a\left(mol\right)\)
\(n_{H_2\left(2\right)}=n_{Fe}=b\left(mol\right)\)
=> \(\frac{3}{2}a+b=0,4\left(II\right)\)
Từ (I) và (II) => \(\hept{\begin{cases}a=0,2\\b=0,1\end{cases}}\)
=> \(\hept{\begin{cases}m_{Al}=27\cdot0,2=5,4\left(g\right)\\m_{Fe}=56\cdot0,1=5,6\left(g\right)\end{cases}}\)

Fe + S → t ∘ FeS
S + O2 → t ∘ SO2
FeS + O2 → t ∘ Fe2O3 + SO2

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g
Chọn D
Phản ứng nhiệt nhôm là phản ứng của nhôm với oxit kim loại
→ Al tác dụng với axit H 2 S O 4 đặc nóng không phải là phản ứng nhiệt nhôm