Điện phân dung dịch X gồm CuSO4 và KCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I = 2A. Sau 4825 giây, thu được dung dịch Y (vẫn còn màu xanh) và 0,04 mol hỗn hợp khí ở anot. Biết Y tác dụng tối đa với 0,06 mol KOH trong dung dịch. Mặt khác, nếu điện phân X trong thời gian t giây thì thu được 0,09 mol hỗn hợp khí ở hai điện cực. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Giá trị của t là
A. 9650.
B. 6755.
C. 8685.
D. 5790.

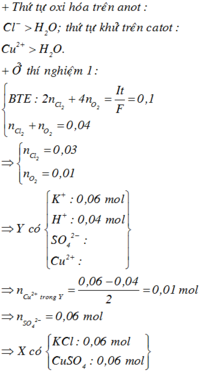
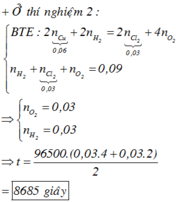



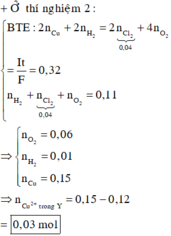
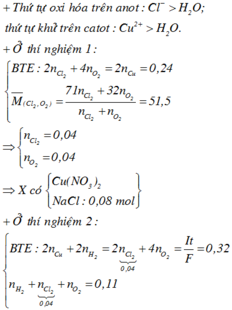
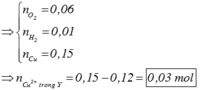



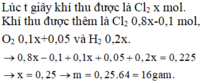
Đáp án C
Số mol khí là:
0 , 03 + y + 2 y - 0 , 03 = 0 , 09 ⇒ y = 0 , 03 ⇒ n e = 0 , 18 ⇒ t = 8685 s