Trộn 0,25 mol bột Al với 0,15 mol bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ có phản ứng khử Fe2O3 về Fe) thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, m gam chất rắn khan Z và 0,15 mol H2. Hiệu suất phản ứng nhiệt nhôm và giá trị của m lần lượt là
A. 60% và 20,40
B. 60% và 30,75
C. 50% và 20,75
D. 50% và 40,80


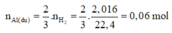
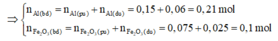
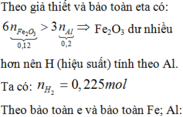


Đáp án A
n Al dư = 2nH2 / 3 = 0,1 mol
⇒ H = (0,25 – 0,1)/0,25 .100%= 60%
2Al + Fe2O3 → Al2O3 +2Fe
0,15
⇒ mZ = 160.(0,15 – 0,075) + 56.0,15 = 20,4 g