Có một loại quặng pirit chứa 96% FeS2. Nếu mỗi ngày nhà máy sản xuất 100 tấn axit sunfuric 98% thì cần m tấn quặng pirit trên và biết hiệu suất của cả quá trình sản xuất H2SO4 là 90%. Gía trị của m là:
A. 69,44 tấn
B. 68,44tấn
C. 67,44 tấn
D. 70,44tấn

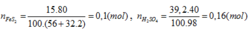

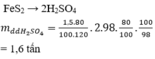

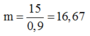
Đáp án A