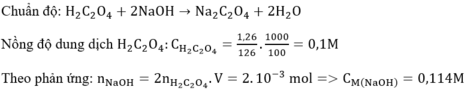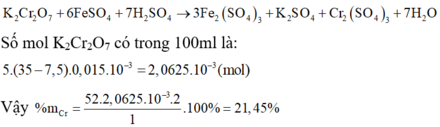Nghiền 20 viên thuốc thành bột mịn. Cân 1,0314 g bột thuốc hòa tan trong dung môi và định mức 100 mL. Hút 1,00 mL dung dịch này định mức tiếp 10 mL. Hút 2,00 mL dung dịch vừa chuẩn bị tiến hành phân tích thu được kết quả sắt = 0,64.10-8% g/mL. Tính nồng độ ppb của sắt trong thuốc phân tích.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Học sinh tiến hành thí nghiệm, ghi giá trị mA và mB. Hiện tượng thí nghiệm: Xuất hiện kết tủa trắng.
- Ta có mA = mB.
Nhận xét: tổng khối lượng của các chất trước phản ứng bằng tổng khối lượng của các chất sau phản ứng.

Trong 50 ml dd có 1 gam acid.
Ta có: \(n_{NaOH}=0,0327.0,5=0,01635\left(mol\right)\)
\(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
\(\Rightarrow n_{CH_3COOH\left(trong50ml\right)}=n_{NaOH}=0,01635\left(mol\right)\)
\(\Rightarrow m_{CH_3COOH\left(trong50ml\right)}=0,01635.60=0,981\left(g\right)\)
\(\Rightarrow\%m_{CH_3COOH}=\dfrac{0,981}{1}.100\%=98,1\%\)

Đáp án C
6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
n FeSO 4 dư = 0,0075.0,015 = 1,125. 10 - 4 mol
25 ml FeSO4 tương đương với 35 ml dung dịch chuẩn K2Cr2O7
=> n K 2 Cr 2 O 7 phản ứng = 35 - 7 , 5 1000 . 0 , 015 = 4 , 125 . 10 - 4 mol
⇒ n Cr ( quặng ) = 2 n K 2 Cr 2 O 7 phải ứng . 100 20 = 4 , 125 . 10 - 3 mol
⇒ % m Cr ( quặng ) = 52 . 4 , 125 . 10 - 3 1 . 100 % = 21 , 45 %

Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
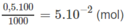
Số mol NaOH trong 33,4 ml nồng độ 1M :
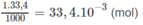
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 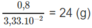
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.