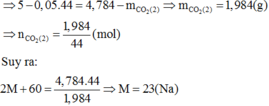5 câu trắc nghiệm ạ
Câu 20. Một đĩa cân A đặt ít bột nhôm và xếp trên đĩa cân B những quả cân sao cho kim cân ở vị trí thăng bằng. Khi đốt cháy hết bột nhôm trên đĩa cân A thì vị trí của kim cân sẽ
A. không thay đổi.
B. không xác định được.
C. lệch về phía đĩa cân B.
D. lệch về phía đĩa cân A.
Câu 22: Nguyên tố kim loại X có hoá trị III, nguyên tố phi kim Y có hoá trị II. Hợp chất của X và Y có công thức phân tử là : A . XY C. X3Y3 B . X2Y3 D . XY3
Câu 23 :Đốt cháy 18g kim loại magie trong không khí thu được 30g magieoxit .Tính khối lượng oxi đã tham gia phản ứng.
A. 48g B.56g C. 12g D.78g
Câu 24, :Phân hủy 200g đá vôi ,thành phần chính là canxicacbonat (CaCO3) thu được 56g vôi sống(CaO) và 44g CO2 .Tính tỉ lệ phần trăm về khối lượng canxicacbonat chứa trong đá vôi.
A. 44% B.56% C. 100% D.50%
Câu 25. Cho kim loại M tạo ra hợp chất MSO4. Biết phân tử khôi là 233. Xác định kim loại M
A. Magie B. Bari C. Sắt D. Bạc