Tính khối lượng và thể tích khí Clo cần dùng (đktc) để điều chế a,68 gam muối natri clorua. Biết hiệu suất phản ứng là 70 %
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PT: \(2Na+Cl_2\underrightarrow{t^o}2NaCl\)
Ta có: \(n_{NaCl}=\dfrac{4,68}{58,5}=0,08\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Na\left(LT\right)}=n_{NaCl}=0,08\left(mol\right)\\n_{Cl_2\left(LT\right)}=\dfrac{1}{2}n_{NaCl}=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na\left(LT\right)}=0,08.23=1,84\left(g\right)\\V_{Cl_2\left(LT\right)}=0,04.22,4=0,896\left(l\right)\end{matrix}\right.\)
Mà: H% = 80%
\(\Rightarrow\left\{{}\begin{matrix}m_{Na\left(TT\right)}=\dfrac{1,84}{80\%}=2,3\left(g\right)\\V_{Cl_2\left(TT\right)}=\dfrac{0,896}{80\%}=1,12\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

\(n_{NaCl}=\dfrac{4,68}{58,5}=0,08\left(mol\right)\)
PTHH: 2Na + Cl2 --to--> 2NaCl
0,08<-0,04<-----0,08
\(m_{NaCl\left(pư\right)}=0,08.23=1,84\left(g\right)\)
=> \(m_{NaCl\left(tt\right)}=\dfrac{1,84.100}{80}=2,3\left(g\right)\)
\(n_{Cl_2\left(tt\right)}=\dfrac{0,04.100}{80}=0,05\left(mol\right)\)
=> VCl2 = 0,05.22,4 = 1,12 (l)

1.
mNaCl lí thuyết = \(\dfrac{4,68.100}{80}\) = 5,85 (g)
=> nNaCl lí thuyết = \(\dfrac{5,85}{58,5}\) = 0,1 (mol)
2Na + Cl2 ----> 2NaCl
0,1 0,05 0,1 (mol)
=> mNa = 0,1.23 = 2,3 (g)
=> VCl2 = 0,05.22,4 = 1,12 (l)
2.
nZn = \(\dfrac{19,5}{65}\)= 0,3 (mol)
nCl2 = \(\dfrac{7}{22,4}\)= 0,3125 (mol)
Zn + Cl2 ----> ZnCl2
0,3 0,3 (mol)
Tỉ lệ: \(\dfrac{0,3}{1}<\dfrac{0,3125}{1}\)=> Zn phản ứng hết, Cl2 phản ứng dư.
=> mZnCl2 lí thuyết 0,3.136 = 40,8 (g)
=> H = \(\dfrac{36,72.100}{40,8}\)= 90%

PTHH: 2Na+Cl2\(\rightarrow\)2NaCl
nNaCl=\(\dfrac{8,775}{58.5}=0,15\left(mol\right)\)
nếu hiệu suất là 100% thì nNaCl=0,15/\(\dfrac{75}{100}\)=0,2(mol)
theo PTHH: nNa=nNaCl=0,2
\(\rightarrow\)mNa=0,2.23=4,6(g)
theo PTHH: nCl2=\(\dfrac{1}{2}\)nNaCl=0,1
\(\rightarrow\)VCl2=0,1.22,4=2,24(l)
2Na +Cl2 --> 2NaCl
nNaCl=8,775/58,5=0,15(mol)
theo PTHH : nCl2=1/2nNaCl=0,075(mol)
mà H=75% =>nCl2(thực tế)=0,075/75.100=0,1(mol)
=>mCl2=0,1.71=7,1(g)
nNa=nNaCl=0,15(mol)
mà H=75%=>nNa(thực tế )=0,15/75.100=0,2(mol)
=>mNa=0,2.23=4,6(g)

Vì hiệu suất là 25%
=> \(m_{NH_3}=17.\dfrac{25\%}{100\%}=4,25\left(g\right)\)
Ta có: \(n_{NH_3}=\dfrac{4,25}{17}=0,25\left(mol\right)\)
PTHH: N2 + 3H2 ---> 2NH3
Theo PT: \(n_{H_2}=\dfrac{3}{2}.n_{NH_3}=\dfrac{3}{2}.0,25=0,375\left(mol\right)\)
=> \(V_{H_2}=0,375.22,4=8,4\left(lít\right)\)
Theo PT: \(n_{N_2}=\dfrac{1}{2}.n_{NH_3}=\dfrac{1}{2}.0,25=0,125\left(mol\right)\)
=> \(V_{N_2}=0,125.22,4=2,8\left(lít\right)\)
\(n_{NH_3}=1\left(mol\right)\)
Bảo toàn nguyên tố:
\(\left\{{}\begin{matrix}n_{N_2}=\dfrac{n_{NH_3}}{2}=0,5\left(mol\right)\\n_{H_2}=\dfrac{3n_{NH_3}}{2}=1,5\left(mol\right)\end{matrix}\right.\)
Do hiệu suất 25% \(\Rightarrow\left\{{}\begin{matrix}n_{N_2}=2\left(mol\right)\\n_{H_2}=6\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}V_{N_2}=44,8\left(l\right)\\n_{H_2}=134,4\left(l\right)\end{matrix}\right.\)

Câu 8:
\(n_{Cl_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2KMnO4 + 16HCl --> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,1<---------------------------------0,25
=> \(n_{KMnO_4\left(tt\right)}=\dfrac{0,1.100}{80}=0,125\left(mol\right)\)
=> mKMnO4(tt) = 0,125.158 = 19,75 (g)
Câu 18:
\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> n2 muối cacbonat = 0,1 (mol)
Câu 8: 2KMnO4 (0,125 mol) + 16HCl (đậm đặc) \(\underrightarrow{H=80\%}\) 2KCl + 2MnCl2 + 5Cl2\(\uparrow\) (0,25 mol) + 8H2O.
Khối lượng thuốc tím cần dùng là 0,125.158=19,75 (g).
Câu 18: 2H+ + CO32- (0,1 mol) \(\rightarrow\) CO2 (0,1 mol) + H2O.
Số mol của hỗn hợp hai muối cacbonat là 0,1 mol.

1. Tính khối lượng chất tham gia và sản phẩm
* Các bước giải:
- Đổi số liệu đầu bài. Tính số mol của chất mà đầu bài cho.
- Lập phương trình hoá học.
- Dựa vào số mol chất đã biết để tính số mol chất cần tìm.
2. Tính thể tích khí tham gia và tạo thành
H2+Cl2->2HCl
\(n_{H_2}=67,2:22,4=3\left(mol\right)\)
Ta có: \(n_{H_2}=n_{Cl_2}=3\left(mol\right)\)
\(V_{Cl_2}=3.22,4=67,2l\)
\(n_{HCl}=2n_{Cl_2}=2.3=6\left(mol\right)\)
\(m_{HCl}=6.36,5=219g\)
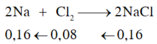
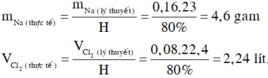
2Na+Cl2->2NaCl
nNaCl=4,68/58,5=0,08 mol
=>nNa=0,08 mol
nCl2=0,04 mol
mNa=0,08x23/80%=2,3 g
VCl2=0,04x22,4/70%=1,28 l
buithianhtho chịu á..làm trc khi bạn ý nói 4,68