Cho 0.786 g bột A gồm Al, Fe, Cu tác dụng hoàn toàn với 20 ml dung dịch CuSO4 1M thu được dung dịch B và hỗn hợp D gồm 2 kim loại . Cho NaOH tác dụng từ từ với dung dịch B cho đến khi thu được lượng kết tủa lớn nhất; nung kết tủa trong không khí đến khối lượng không đổi thì thu được 0.91 g hỗn hợp 2 oxit. Cho D tác dụng hoàn toàn với dung dịch AgNO3 thì lượng Ag thu được lớn hơn khối lượng của D là 3.668g. Tính số gam kim loại trong A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt: Số mol của Al và Fe phản ứng lần lượt là x,y (mol) (x,y>0)
BT electron:
\(3.a+2.b=2.0,04.1\\ \Leftrightarrow3a+2b=0,08\left(1\right)\)
2 kim loại hỗn hợp D có thể là Fe(dư) và Cu (chưa phản ứng+sau phản ứng) (do Al mạnh nhất nên đã hết)
Ta biết được CuSO4 vì kim loại còn dư. Ta sẽ có PTHH:
\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\\Fe+CuSO_4\rightarrow FeSO_4+Cu\\ Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\\ 2Al\left(OH\right)_3\rightarrow\left(t^o\right)Al_2O_3+3H_2O\\4Fe\left(OH\right)_2+O_2\rightarrow\left(t^o\right)2Fe_2O_3+4H_2O\\ Vì:m_{oxit}=1,82\left(g\right)\\ \Leftrightarrow\dfrac{102.a}{2}+\dfrac{160b}{2}=1,82\\ \Leftrightarrow51a+80b=1,82\left(2\right)\)
(1), (2) ta được hpt:
\(\left\{{}\begin{matrix}3a+2b=0,08\\51a+80b=1,82\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,02\\b=0,01\end{matrix}\right.\)
=> nCu vừa bị đẩy ra là 0,04 mol. Ta đặt m,n lần lượt là số mol của Fe(dư) và Cu(hh ban đầu)
\(\Rightarrow m_A=2,3\left(g\right)\\ \Leftrightarrow56m+64n+0,02.27+0,01.56=2,3\\ \Leftrightarrow56m+64n=1,2\left(3\right)\)
BT Ag:
\(n_{Ag}=3m+2n+2.0,04=0,12\\ \Leftrightarrow3m+2n=0,04\left(4\right)\\ \left(3\right),\left(4\right)\Rightarrow\left\{{}\begin{matrix}3m+2n=0,04\\56m+64n=1,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}m=0,002\\n=0,017\end{matrix}\right.\)
\(\Rightarrow hhA\left\{{}\begin{matrix}m_{Fe}=0,002.56+0,01.56=0,672\left(g\right)\\m_{Cu}=0,017.64=1,088\left(g\right)\\m_{Al}=2,3-0,672-1,088=0,54\left(g\right)\end{matrix}\right.\)

Đáp án A
Vì T gồm hai kim loại nên T chứa Cu và Fe dư. Khi đó Cu3+ phản ứng hết và dung dịch Z có Al3+ và có thể có Fe2+.
Theo định luật bảo toàn điện tích, ta có:
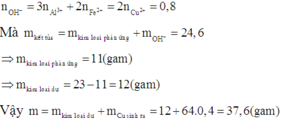

\(Mg>Fe\) => `Mg` phản ứng trước
\(Mg+Cu^{2+}\rightarrow Mg^{2+}+Cu^o\)
x----->x-------------------->x
\(Fe+Cu^{2+}\rightarrow Fe^{2+}+Cu^o\)
y----->y----------------->y
Giả sử nếu \(Cu^{2+}\) chuyển hết thành \(Cu^o\)
\(\Rightarrow n_{Cu^o}=n_{Cu^{2+}}=n_{kt}\)
Có \(n_{Cu^{2+}}=0,2.1=0,2\left(mol\right)\)
\(n_{kt}=\dfrac{15,6}{64}=0,24375\left(mol\right)>0,2\left(mol\right)\)
\(\Rightarrow\)Giả sử sai, kim loại Fe trong hỗn hợp X còn dư
Theo đề có: \(m_{Fe.dư}=m_{kt}-m_{Cu}=15,6-0,2.64=2,8\left(g\right)\)
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}24x+56y=9,2-2,8=6,4\\x+y=0,2\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,05\end{matrix}\right.\)
a. Trong X có:
\(\left\{{}\begin{matrix}m_{Mg}=24.0,15=3,6\left(g\right)\\m_{Fe}=56.0,05+2,8=5,6\left(g\right)\end{matrix}\right.\)
b
Y: \(\left\{{}\begin{matrix}n_{MgSO_4}=x=0,15\left(mol\right)\\n_{FeSO_4}=y=0,05\left(mol\right)\end{matrix}\right.\)
\(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2+Na_2SO_4\)
0,15--------------------->0,15
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
0,05-------------------->0,05
\(m_{kt}=m_{Mg\left(OH\right)_2}+m_{Fe\left(OH\right)_2}=0,15.58+0,05.90=13,2\left(g\right)\)

Định hướng tư duy giải
Ta có:
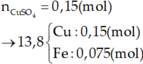
Dễ thấy 6 gam rắn là Fe2O3
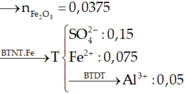
Có Al dư → Phần X phản ứng:
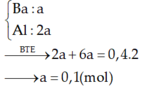
Chú ý: Vì chất tan thu được là Ba(AlO2)2→ tỷ lệ mol Ba : Al phải là 1 : 2
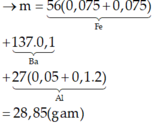





Cù Văn Thái