Bài 1: Lập công thức các bazơ ứng với các oxit sau đây:
CuO, FeO, Na2O, BaO, Fe2O3, MgO.
Bài 2:
Kẽm tác dụng với axit sunfuric theo sơ đồ sau:
Zn + H2SO4 ➞ ZnSO4 + H2
Có 13g kẽm tham gia phản ứng. Tính:
a) Khối lượng axit tham gia phản ứng.
b) Khối lượng muối ZnSO4 tạo thành.
c) Thể tích khí hidro thu được sau phản ứng (đktc)
Bài 3: Người ta nung canxi cacbonat (CaCO3) ở nhiệt độ cao, thu được canxi oxit (CaO) và 5,6 lít khí cacbonic (CO2).
a) Viết PTHH.
b) Tính khối lượng CaCO3 tham gia phản ứng.
c) Tính khối lượng CaO thu được sau phản ứng.
Bài 4: Trong phòng thí nghiệm, để điều chế khí oxi, người ta nung nóng 73,5g muối KClO3 ở nhiệt độ cao, thu được muối KCl và khí oxi.
a) Viết PTHH
b) Tính khối lượng muối KCl.
c) Tính thể tích khí oxi sinh ra (đktc).
Bài 5: Đốt cháy 13,5g Al trong bình chứa khí oxi thu được Al2O3.
a) Viết PTHH.
b) Tính khối lượng Al2O3 thu được sau phản ứng.
c) Tính thể tích khí oxi tham gia phản ứng (đktc).
mn giúp giùm mik với ạ. Mk đang cần gấp lắm. Mơn mn nhìu

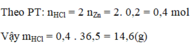

Bài 1:
Bài 2
Zn + H2SO4 ➞ ZnSO4 + H2
n Zn=13/65=0,2(mol)
a) n H2SO4=n Zn=0,2(mol)
m H2SO4=0,2.98=19,6(g)
b) n ZnSO4=n Zn=0,2(mol)
m ZnSO4=0,2.161=32,2(g)
c) n H2=n Zn=0,2(mol)
V H2=0,2.22,4=4,48(l)
Bài 3:
a) CaCO3--->CaO+CO2
b) n CO2=5,6/22,4=0,25(mol)
n CaCO3=n CO2=0,25(mol)
m CaCO3=0,25.100=25(g)
c) n CaO=n CO2=0,25(mol)
m caO=0,25.56=14(g)
Bài 4:
a) 2KClO3--->2KCl+3O2
b) n KClO3=73,5/122,5=0,6(mol)
n KCl=n KClO3=0,6(mol)
m KCl=0,6.74,5=44,7(g)
c) n O2=3/2n KClO3=0,9(mol)
V O2=0,9.22,4=20,16(l)
Bài 5
a) 4Al+3O2---.2Al2O3
b)n Al=13,5/27=0,5(mol)
n Al2O3=1/2n Al=0,25(mol)
m Al2O3=0,25.102=25,5(g)
c) n O2=3/4n Al=0,375(mol)
V O2=0,375.22,4=8,4(l)
Bài 4: Trong phòng thí nghiệm, để điều chế khí oxi, người ta nung nóng 73,5g muối KClO3 ở nhiệt độ cao, thu được muối KCl và khí oxi.
a) Viết PTHH
b) Tính khối lượng muối KCl.
c) Tính thể tích khí oxi sinh ra (đktc).
-------------------------------------------
\(PTHH:2KClO_3\rightarrow2KCl+3O_2\)
\(-----0,6----0,6--0,9\)
\(n_{KClO_3}=\frac{73,5}{122,5}=0,6\left(mol\right)\)
\(m_{KCl}=0,6.74,5=44,7\left(g\right)\)
\(V_{O_2}=0,9.22,4=20,16\left(l\right)\)
Bài 5: Đốt cháy 13,5g Al trong bình chứa khí oxi thu được Al2O3.
a) Viết PTHH.
b) Tính khối lượng Al2O3 thu được sau phản ứng.
c) Tính thể tích khí oxi tham gia phản ứng (đktc).
------------------------------------
\(PTHH:4Al+3O_2\rightarrow2Al_2O_3\)
\(n_{Al}=\frac{13,5}{27}=0,5\left(mol\right)\)
\(n_{Al_2O_3}=\frac{1}{2}n_{Al}=0,25\left(mol\right)\)
\(m_{Al_2O_3}=102.0,25=22,5\left(g\right)\)
\(n_{O_2}=\frac{3}{4}n_{Al}=0,375\left(mol\right)\)
\(V_{O_2}=22,4.0,375=8,4\left(l\right)\)
Vậy .........