Cần tối thiểu bao nhiêu gam KMnO4 và bao nhiêu lít dd HCl 5M để điều chế đủ khí Clo tác dụng với Fe, tạo nên 65g FeCl3 ?
#NTHM
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{FeCl_3}=\dfrac{16.25}{162.5}=0.1\left(mol\right)\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{t^0}FeCl_3\)
\(......0.15......0.1\)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(0.06...............0.48........................................0.15\)
\(m_{KMnO_4}=0.06\cdot158=9.48\left(g\right)\)
\(V_{dd_{HCl}}=\dfrac{0.48}{1}=0.48\left(l\right)=480\left(ml\right)\)
\(2Fe+ 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Cl_2} = \dfrac{3}{2}n_{FeCl_3} = \dfrac{3}{2}.\dfrac{16,25}{162,5} = 0,15(mol)\\ 2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O\\ n_{KMnO_4} = \dfrac{2}{5}n_{Cl_2} = 0,06(mol)\\ \Rightarrow m_{KMnO_4} = 0,06.158 = 9,48(gam)\\ n_{HCl} = \dfrac{16}{4}n_{Cl_2} = 0,48(mol)\\ \Rightarrow V_{dd\ HCl} = \dfrac{0,48}{1} = 0,48(lít) = 480(ml)\)

2Fe+ 3Cl2=(t0) 2FeCl3
nFeCl3=16,25/162,5=0,1 mol => nCl2=3/2nFeCl3=3/2.0,1=0,15 mol
2KMnO4+ 16HCl=2KCl+2MnCl2+5Cl2+8H2O
nKMnO4=2/5.nCl2=2/5. 0,15=0,06 mol --> mKMnO4=0.06. 158=9,48 g
nHCl=16/5. nCl2=16/5. 0,15=0,48 mol
--> VddHCl=0,48/ 1=0,48 lit= 480 ml

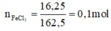
Phương trình hóa học của phản ứng:
3Cl2 + 2Fe → 2FeCl3
Theo pt: 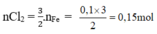
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Theo pt:
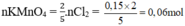
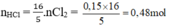
mKMnO4 cần = 0,06. 158 = 9,48g
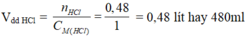

2Fe + 3Cl2 --> 2FeCl3
16,25 gam FeCl3 tương đương với 0,1 mol FeCl3
Từ phương trình ta thấy để tạo ra được 0,1 mol FeCl3 thì số mol Cl2 dùng để phản ứng = 0.1.3/2 = 0,15 mol
Điều chế Clo: MnO2 + 4HCl --> MnCl2 + Cl2 + H2O
Mà để điều chế 0,15 mol Cl2 thì cần 0,15 mol MnO2 tức 0,15.87=13,05 gam MnO2 và 0,6 mol HCl => VHCl 1M = 0,6 lít

2KMnO4 + 16HCl ---> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2Fe + 3Cl2 ---> 2FeCl3
Để điều chế đủ khí Clo thì số mol Cl2 = 3/2 số mol FeCl3 = 1,5.16,25/162,5 = 0,15 mol.
Số mol KMnO4 = 2/5 số mol Cl2 = 0,06 mol; m(KMnO4) = 0,06.158 = 9,48 g
V(HCl) = 0,48/1 = 480 ml.
KMnO4 + 16HCl ---> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2Fe + 3Cl2 ---> 2FeCl3
Để điều chế đủ khí Clo thì số mol Cl2 = 3/2 số mol FeCl3 = 1,5.16,25/162,5 = 0,15 mol.
Số mol KMnO4 = 2/5 số mol Cl2 = 0,06 mol; m(KMnO4) = 0,06.158 = 9,48 g
V(HCl) = 0,48/1 = 480 ml.

\(n_{Cl_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(2KMnO_4+16HCl_{\left(đ\right)}\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(0.2...................1.6...........................................0.5\)
\(m_{KMnO_4}=0.2\cdot158=31.6\left(g\right)\)
\(V_{dd_{HCl}}=\dfrac{1.6}{1}=1.6\left(l\right)=1600\left(ml\right)\)
\(n_{Cl_2}=\dfrac{11,2}{22,4}=0,5(mol)\\ PTHH:2KMnO_4+16HCl\to 2KCl+2MnCl_2+5Cl_2+8H_2O\\ \Rightarrow n_{KMnO_4}=\dfrac{2}{5}n_{Cl_2}=0,2(mol);n_{HCl}=\dfrac{16}{5}n_{Cl_2}=1,6(mol)\\ \Rightarrow m_{KMnO_4}=0,2.158=31,6(g);V_{dd_{HCl}}=\dfrac{1,6}{1}=1,6(l)=1600(ml)\)

2Al+6HCl->2AlCl3+3H2
0,5----1,5-------------------------0,75
n H2=0,075 mol
cần 10 quả bóng =>0,075.10=0,75 mol
=>mAl=0,5.27=13,5g
m HCl=1,5.36,5=54,75g
=>m dd=75g
\(n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\\
pthh:2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,1125 0,15 0,075
\(m_{Al}=0,1125.27=3,0375\left(g\right)\\
m_{HCl}=\dfrac{\left(0,15.36,5\right).100}{7,3}=75\left(g\right)\)

n FeCl3=65/162,5=0,4(mol)
3Cl2+2Fe----->2FeCl3
0,6<-----------0,4(mol)
2KMnO4+16HCl---->5Cl2+ 8H2O+2MnCl2+2KCl
0,24<-------1,92----0,6(mol)
m KMnO4=0,24.158=37,92(g)
V HCl=1,92/5=0,384(l)
Chúc bạn hcoj tốt