Hòa tan hoàn toàn 4 gam hõn hợp Fe và Cu bằng một lượng dư H2SO4 đặc nóng thu được khí A và dung dịch B. Hấp thụ hoàn toàn khí A vào 125 gam dung dịch NaOH, rồi đem cô cạn dung dịch tạo thành được 16,6 gam chất rắn C. Mặt khác cho lượng dư dung dịch NaOH vào dung dịch B, phản ứng xong lọc lấy kết tủa tạo thành, nung đến khối lượng không đổi thu được 5,6 gam chất rắn E. Tính nồng dộ % của dung dịch NaOH đã dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Vì H2SO4 đặc nóng dư nên khí A sinh ra là SO2.
Muối khan thu được là
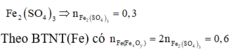
Vì dung dịch NaOH dư nên khỉ dẫn SO2 vào đung dịch NaOH chỉ xảy ra một phản ứng:
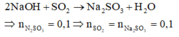
Coi oxit FexOy ban đầu là hỗn hợp của Fe và O.
Gọi nO = a.
Áp dụng định luật bảo toàn moi electron, ta có:



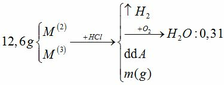
Đồng nhất dữ kiện để thuận lợi cho tính toán, bằng cách nhân đôi khối lượng H2O.
a.
BTNT H: nH2 = nH2O = 0,31 mol
=> nHCl = 0,62mol
BTKL: m kim loại + mHCl = mA + mB => 12,6 + 36,5 . 0,62 = m + 2 . 0,31 => m = 34,61g
b.
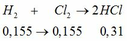

a, \(Fe_3O_4+4H_2SO_4\rightarrow FeSO_4+Fe_2\left(SO_4\right)_3+4H_2O\) (1)
\(Cu+Fe_2\left(SO_4\right)_3\rightarrow CuSO_4+2FeSO_4\) (2)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\) (3)
\(2Fe_3O_4+10H_2SO_{4\left(đ\right)}\underrightarrow{t^o}3Fe_2\left(SO_4\right)_3+SO_2+10H_2O\) (4)
\(5SO_2+2KMnO_4+2H_2O\rightarrow2MnSO_4+K_2SO_4+2H_2SO_4\) (5)
b, - K là Fe3O4 dư. → mFe3O4 (dư) = 0,4 (g)
- B gồm: CuSO4, FeSO4 và Fe2(SO4)3.
Gọi: số mol Cu, Fe3O4 pư với H2SO4 loãng lần lượt là: x, y (mol)
⇒ 64x + 232y = 8 - 0,4 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{FeSO_4\left(1\right)}=n_{Fe_2\left(SO_4\right)_3\left(1\right)}=n_{Fe_3O_4}=y\left(mol\right)\\n_{CuSO_4}=n_{Fe_2\left(SO_4\right)_3\left(2\right)}=n_{Cu}=x\left(mol\right)\\n_{FeSO_4\left(2\right)}=2n_{Cu}=2x\left(mol\right)\end{matrix}\right.\)
→ Trong B có: CuSO4: x (mol), FeSO4: y + 2x (mol) và Fe2(SO4)3: y - x (mol)
⇒ 160x + 152(y+2x) + 400(y-x) = 17,2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,01\left(mol\right)\\y=0,03\left(mol\right)\end{matrix}\right.\)
⇒ mCuSO4 = 0,01.160 =1,6 (g)
mFeSO4 = (0,03+2.0,01).152 = 7,6 (g)
mFe2(SO4)3 = (0,03-0,01).400 = 8 (g)
c, Trong 8 (g) hh có Cu: 0,01 (mol) và Fe3O4: 0,03 + 0,4/232 = 23/725 (mol)
Theo PT: \(n_{SO_2}=n_{Cu}+\dfrac{1}{2}n_{Fe_3O_4}\approx0,026\left(mol\right)\)
\(n_{KMnO_4}=0,04.1=0,04\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,026}{5}< \dfrac{0,04}{2}\), ta được KMnO4 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{KMnO_4\left(pư\right)}=n_{MnSO_4}=n_{H_2SO_4}=\dfrac{2}{5}n_{SO_2}=0,0104\left(mol\right)\\n_{K_2SO_4}=\dfrac{1}{5}n_{SO_2}=0,0052\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{KMnO_4\left(dư\right)}=0,04-0,0104=0,0296\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{KMnO_4}\left(dư\right)}=\dfrac{0,0296}{0,04}=0,74\left(M\right)\\C_{M_{MnSO_4}}=C_{M_{H_2SO_4}}=\dfrac{0,0104}{0,04}=0,26\left(M\right)\\C_{M_{K_2SO_4}}=\dfrac{0,0052}{0,04}=0,13\left(M\right)\end{matrix}\right.\)







Gọi số mol Fe, Cu trong hỗn hợp là x, y
mhh = 56x + 64y = 4(g) (1)
2Fe + 6H2SO4 đn → Fe2(SO4)3 + 3SO2↑ + 6H2O
x___________________\(\frac{x}{2}\)_________\(\frac{3x}{2}\)
Cu + 2H2SO4 đn → CuSO4 + SO2↑ + 2H2O
y __________________y_______ y
Dung dịch B gồm: Fe2(SO4)3 (\(\frac{x}{2}\)mol); CuSO4 (y mol), H2SO4 dư
Cho B tác dụng với NaOH dư:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3↓ + 3Na2SO4
\(\frac{x}{2}\)______________________x
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
y___________________y
Nung kết tủa đến khối lượng không đổi:
2Fe(OH)3 \(\underrightarrow{^{to}}\)Fe2O3 + 3H2O
x___________\(\frac{x}{2}\)__________
Cu(OH)2 \(\underrightarrow{^{to}}\) CuO + H2O
y_________y
mcr E = mFe2O3 + mCuO
→ 80x + 80y = 5,6 (2)
Từ (1) và (2) → x = 0,06; y = 0,01
\(n_{SO2}=\frac{3.0,06}{2}+0,01=0,1\left(mol\right)\)
SO2 + 2NaOH → Na2SO3 + H2O
0,1_____0,2 ______0,1
mNa2SO3 = 0,1 . 126 = 12,6 (g) < 16,6
→ C còn NaOH dư
mNaOH dư = 16,6 - 12,6 = 4 (g)
mNaOH đã dùng = 0,2 . 40 + 4 = 12 (g)
\(C\%_{NaOH}=\frac{12}{125}.100\%=9,6\%\)
cám ơn :3