Hỗn hợp gồm có 8g bột S và 28g bột Fe. Đốt nóng hỗn hợp thu được chất duy nhất là FeS. Tính khối lượng của sản phẩm. Tính khối lượng hợp chất sinh ra và khối lượng chất còn dư sau phản ứng (nếu có)
Bài này em đang cần gấp lắm ạ
Mong mn giúp đỡ ạ
(Giải theo chương trình lớp 8)


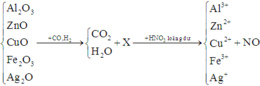
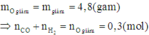
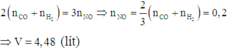
S+Fe-->FeS
Ta có
n\(_S=\frac{8}{32}=0,25\left(mol\right)\)
n\(_{Fe}=\frac{28}{56}=0,5\left(mol\right)\)
=> Fe dư
Theo pthh
n\(_{FeS}=n_S=0,25\left(mol\right)\)\
m\(_{FeS}=0,25.88=22\left(g\right)\)
Theo pthh
n\(_{Fe}=n_S=0,25\left(mol\right)\)
n\(_{Fe}dư=0,5-0,25=0,25\left(mol\right)\)
m\(_{Fe}dư=0,25.56=14\left(g\right)\)
Chúc bạn học tốt
Ta có ;
nS = 0,25 (mol)
nFe = 0,5(mol)
=>Fe dư
PTHH : Fe+S--->FeS
=> nFeS = 025=>mFeS = 0,25 . 88 = 22(g)
=>nFe = 0,25 (mol)=>nFe dư = 0,25 (mol) = >mFe dư = 14 (g)