1, Có oxit sắt chưa biết
- hòa tan m gam oxit cần 150 ml HCl 3M
- Khử toàn bộ m gam oxit bằng CO nóng, dư thu được 8,4g sắt
Tìm CT của oxit
2, Cho 416g dd BaCl2 12% td vừa đủ với dd chứa 27,36g muối sunfat kim loại A. Sau khi lọc bỏ kết tủa thu được 800ml dd 0,2M của muối clorua KL A. Tìm hóa trị A, tên A và công thức muối sunfat
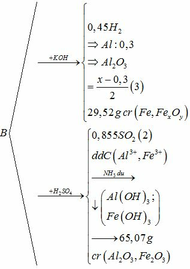
3, Cho 15,25g hh 1 KL hóa trị II có lẫn Fe tan hết trong axit HCl dư thoát ra 4,48 dm3 H2 (đktc) và thu được dd X. Thêm NaOH gư vào X. Thêm NaOH dư vào X, lọc kết tủa ra rồi nung trong kk đến lg ko đồi cân nặng 12g. Tìm KL hóa trị II, bt nó không tạo kết tủa vs hidroxit
4,Hòa tan hoàn toàn 27,4g hh M2CO3 và MHCO3 bằng dd 500ml dd HCl 1M thoát ra 6,72l CO2(đktc). Để trung hòa axit dư phải dùng V ml dd NaOH 2M
a, Tìm 2 muối và % kl mỗi muối trong hh
b, Tính V
5, Hòa tan 3,2g oxit KL hóa trị III bằng 200g dd H2SO4 loàng. Khi thêm vào hh sau pứ lg CaCO3 vừa đủ còn thấy thoát ra 0,224 dm3 CO2 (đktc). Sau đó cô cạn dd thu được 9,36g muối sunfat khan. Tìm oxit KL hóa trị III và nồng độ % H2SO4



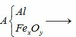
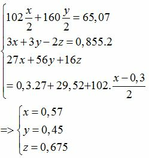
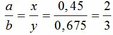
Bài 1 :
Gọi: CT của oxit sắt là : FexOy
nHCl = 0.15*3= 0.45 mol
TN1:
FexOy + 2yHCl --> xFeCl2y/x + yH2O
0.225/y___0.45
TN2:
nFe= 8.4/56=0.15 mol
FexOy + yCO -to-> xFe + yCO2
0.15/x___________0.15
<=> 0.15/x= 0.225/y
<=> x/y = 2/3
Vậy : CT của oxit : Fe2O3