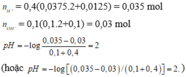trộn 50ml dd ba(oh)2 0,1M vào 50ml dd naoh 0,1M thu đc dd Y . Tính số mol OH- có trong dd Yvà V của hcl 0,2 M và h2so4 0,1M cần để trung hòa 25ml dd Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nồng độ các chất trong 50mL dd X:
NaOH: 0.005 Mol
KOH: 0.005 Mol
Ba(OH)2: 0.01 Mol
Phản ứng của H2SO4 với Ba(OH)2:
H2SO4 + Ba(OH)2 -> BaSO4 + 2H2O
Số mol H2SO4 cần: 0.01 Mol
H+ + OH- -> H2O
Số mol H+ cần: 0.01 Mol => mol H2SO4 cần 0.005 mol.
Lượng mol H2SO4 tổng: 0.015 mol.
=> V H2SO4 = 0.015/0.1 = 0.15 L = 150 mL H2SO4 0.1M

Theo gt ta có: $n_{BaCO_3}=0,001(mol);n_{HCl}=0,06(mol)$
Bảo toàn nguyên tố Ba ta có: $n_{Ba(OH)_2}=0,001(mol)$
\(NaOH+HCl-->NaCl+H_2O\\ Ba\left(OH\right)_2+2HCl-->BaCl_2+2H_2O\)
Suy ra $n_{NaOH}=0,058(mol)$
Từ đó tính được $C_M$

\(n_{H^+}=0.3\cdot0.1\cdot2+0.3\cdot0.15=0.105\left(mol\right)\)
\(n_{OH^-}=0.001V\cdot0.3+0.001V\cdot2\cdot0.1=0.0032V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.105.......0.105\)
\(n_{OH^-\left(dư\right)}=0.0032V-0.105\left(mol\right)\)
\(\left[OH^-\right]=\dfrac{0.0032V-0.105}{0.3+0.001V}\left(M\right)\)
\(pH=14+log\left[OH^-\right]=12\)
\(\Leftrightarrow log\left[OH^-\right]=-2\)
\(\Leftrightarrow log\left[\dfrac{0.0032V-0.105}{0.3+0.001V}\right]=-2\)
\(\Leftrightarrow V=33.85\left(ml\right)\)
nH+=0,3.0,1.2+0,3.0,15=0,105 mol
nOH- ban đầu =0,3V + 0,1.2V=0,5V mol
Sau phản ứng thu được dung dịch có pH=12
⇒OH- dư ⇒ pOH=2
⇒ [OH- ] dư = 0,01 M
nOH- dư = 0,01(0,3+V)=0,003+0,01V (mol)
nOH- phản ứng=nOH- ban đầu - nOH- dư
= 0,5V - 0,003 - 0,01V
= 0,49V - 0,003 (mol )
H+ + OH- → H2O
0,105 → 0,105
nOH- phản ứng = nH+
⇒0,49V - 0,003 =0,105
⇒ V≃0,22 lít=200ml

1. Ptrình ion H(+) + OH(-) = H2O
n H(+) 0,3*0,75*2 + 0,3*1,5 = 0,9mol
=> n OH(-) = 0,9mol => n KOH = 0,9mol => V = 0,6l
2. a) nNaOH= 0,05.20/40=0,025 mol
NaOH + HCl ------> NaCl +H2O
....3x.........3x
2NaOH +H2SO4------> Na2SO4 + 2H2O
.....2x.........x
tỉ lệ mol 2 axit HCl : H2SO4 =3:1
đặt số mol H2SO4 la` x ----> nHCl =3x
>>>>3x+2x =0,025 >>>x=0,05 mol
=>nồng độ mol của HCl va` H2SO4 lần lươt la` 1,5M & 0,5M
b) n(OH-) = nNaOH + 2nBa(OH)2 = 0,2V + 2.0,1.V=0,4V
trong 0,2l ddA có 0,3 mol HCl & 0,1 mol H2SO4 ( vi` V gấp đôi >> n gấp đôi)
=> n(H+)= nHCl + 2nH2SO4 = 0,5mol
ma` n(OH-) =n(H+)
=> 0,4V=0,5 >>V= 1,25l=1250ml
c) nNaOH=0,2.1,25=0,25mol = nBa(OH)2
nH2O = n(axit)= 0,3 +0,1 =0,4 mol
theo BTKL : m(muối) = m(axit) + m(bazo) -m(H2O)
..............................= 0,3.36,5 +0,1.98 + 0,25( 40+171) -0,4.18=66,3g

nNaOH=0,025mol
nH2SO4=0,015mol
2NaOH+H2SO4->Na2SO4+2H2O
Ta có 0,025/2 <0,015/1 =>H2SO4 dư
Khi nhúng quì tím vào dd thì quì tím chuyển sang màu đỏ
2NaOH+H2SO4->Na2SO4+2H2O
0,025 0,0125 0,0125
DD X: H2SO4:0,0025mol
Na2SO4: 0,0125mol
C(H2SO4)=0,00625M
C(NaOH)=0,03125M

1) $n_{NaOH} = 0,015(mol) ; n_{H_2SO_4} = 0,025(mol)$
$2NaOH + H_2SO_4 \to Na_2SO_4 + H_2O$
Ta thấy :
$n_{NaOH} : 2 < n_{H_2SO_4} : 1$ nên $H_2SO_4$ dư
Do đó quỳ tím hóa đỏ.
2)
$n_{Na_2SO_4} = \dfrac{1}{2}n_{NaOH} = 0,0075(mol)$
$n_{H_2SO_4\ dư} = 0,025 - 0,0075 = 0,0175(mol)$
$V_{dd\ X} = 0,15 + 0,25 = 0,4(lít)$
Suy ra :
$C_{M_{Na_2SO_4}} = \dfrac{0,0075}{0,4} = 0,01875M$
$C_{M_{H_2SO_4\ dư}} = \dfrac{0,0175}{0,4} = 0,04375M$
3)
$2KOH + H_2SO_4 \to K_2SO_4 + H_2O$
$n_{KOH} = 2n_{H_2SO_4\ dư} = 0,035(mol)$
$V_{dd\ KOH} =\dfrac{0,035}{1} = 0,035(lít)$