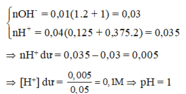(ĐS: pH = 2).
Bài 10. Cho 40 ml dung dịch H2SO4 0,375M vào 160 ml dung dịch chứa đồng thời NaOH 0,16M và KOH 0,04M thu được dd X.
Tính pH của dung dịch X. (Coi H2SO4 phân li hoàn toàn ở 2 nấc). (ĐS: pH = 12)
Nếu cô cạn dd X thì thu được bao nhiêu gam chất rắn khan.