Một hỗn hợp gồm Zn và Fe có khối lượng là 37,2g. Hòa tan hỗn hợp này trong 2l dung dịch H2SO4 0,5M
a. Chứng tỏ rằng hỗn hợp này tan hết
b. Nếu dùng 1 lượng hỗn hợp Zn và Fe gấp đôi trường hợp trước, lượng H2SO4 vẫn như cũ thì hỗn hợp mới này có tan hết hay không?

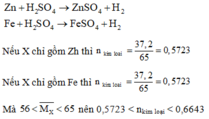

c. Trong trường hợp (1), hãy tính khối lượng mỗi kim loại trong hỗn hợp biết rằn lượng H2 sinh ra trong pư vừa đủ tác dụng với 48g CuO