Đốt cháy hoàn toàn 16 g canxi. cho chất rắn sau phản ứng tác dụng với 18,25 axit HCl. Tính khối lượng các chất còn lại sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Ca}=\dfrac{8}{40}=0,2mol\\ 2Ca+O_2\xrightarrow[]{t^0}2CaO\\ n_{CaO}=n_{Ca}=0,2mol\\ n_{HCl}=\dfrac{18,25}{36,5}=0,5mol\\ CaO+2HCl\rightarrow CaCl_2+H_2O\\ \Rightarrow\dfrac{0,2}{1}< \dfrac{0,5}{2}\Rightarrow HCl.dư\\ n_{CaCl_2}=n_{CaO}=0,2mol\\ n_{HCl}=2n_{CaO}=0,4mol\\ m_{CaCl_2}=0,2.111=22,2g\\ m_{HCl.dư}=\left(0,5-0,4\right).36,5=3,65g\)

2Ca + O2 -> 2CaO (1)
CaO + 2HCl -> CaCl2 + H2O (2)
nCa=0,4(mol)
nHCl=0,5(mol)
Từ 1:
nCaO=nCa=0,4(mol)
Vì \(0,4>\dfrac{0,5}{2}=0,25\) nên sau PƯ 2 thì CaO dư 0,15 mol
Từ 2:
nCaCl2=\(\dfrac{1}{2}\)nHCl=0,25(mol)
mCaCl2=111.0,25=27,75(g)
mCaO=56.0,15=8,4(g)

1.
a, \(n_{Mg}=\dfrac{3,6}{24}=0,15\left(mol\right);n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: 0,15 0,3
b, Ta có: \(\dfrac{0,15}{1}< \dfrac{0,5}{2}\) ⇒ Mg pứ hết, HCl dư
\(m_{HCldư}=\left(0,5-0,3\right).36,5=7,3\left(g\right)\)
c, \(V_{H_2}=0,15.22,4=3,36\left(l\right)\)
2.
a, \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PTHH: 4P + 5O2 ---to→ 2P2O5
Mol: 0,2 0,25 0,1
b, \(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
c, \(m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
d, \(V_{kk}=5,6.5=28\left(l\right)\)

a. Ta có: \(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\)
Ta lại có: \(C_{\%_{HCl}}=\dfrac{m_{ct_{HCl}}}{100}.100\%=7,3\%\)
=> mHCl = 7,3(g)
=> \(n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\)
PTHH:
Fe3O4 + 8HCl ---> FeCl2 + 2FeCl3 + 4H2O
1 ---> 8
0,1 ---> 0,2
=> \(\dfrac{0,1}{1}>\dfrac{0,2}{8}\)
Vậy Fe3O4 dư
=> mdư = 23,2 - 7,3 = 15,9 (g)
b. Theo PT: \(n_{FeCl_2}=\dfrac{1}{8}.n_{HCl}=\dfrac{1}{8}.0,2=0,025\left(mol\right)\)
=> \(m_{FeCl_2}=0,025.127=3,175\left(g\right)\)
Theo PT: \(n_{FeCl_3}=\dfrac{1}{4}.n_{HCl}=\dfrac{1}{4}.0,2=0,05\left(mol\right)\)
=> \(m_{FeCl_3}=0,05.162,5=8,125\left(g\right)\)
=> \(m_{muối}=8,125+3,175=11,3\left(g\right)\)
c. Ta có: mdung dịch sau PỨ = \(23,2+100=123,2\left(g\right)\)
Theo PT: \(n_{H_2O}=\dfrac{1}{2}.n_{HCl}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
=> \(m_{H_2O}=0,1.18=1,8\left(g\right)\)
mcác chất sau PỨ = 1,8 + 11,3 = 13,1(g)
=> \(C_{\%_{sauPỨ}}=\dfrac{13,1}{123,2}.100\%=10,63\%\)

2KMnO4--->MnO2+O2+K2MnO4 (1)
theo bài ra ta có
nKMnO4= \(\frac{79}{158}=0,5\)(mol)
hỗn hợp chất rắn A gồm MnO2 và K2MnO4
theo phương trình (1) ta có
nMnO2= \(\frac{1}{2}x0,5\)= 0,25 (mol)
---> mMnO2= 0.25 x 87=21,75 (g)
nK2MnO4= \(\frac{1}{2}x0,5\)= 0,25 (mol)
----> m K2MnO4= 0,25 x 197=49,25 (g)
--->mA= 21,75+49,25=71 (g)
---> H%= \(\frac{71}{74,2}x100\%\approx95,69\%\)
2)
2) K2MnO4+8 HCl đặc----> 2Cl2+4H2O+2KCl+MnCl2 (2)
MnO2+4 HCl đặc ---> MnCl2 +Cl2+2 H2O (3)
khí thu được là Cl2
Cl2+ Cu-->CuCl2 (4)
3Cl2+2 Fe---> 2FeCl3 (5)
gọi số mol CuCl2 là x (x>0 ;mol)
--> mCucl2= 135x (g)
gọi số mol FeCl3 là y (y>0 ;mol)
---> n FeCl3=162,5 (g)
theo bài ra ta có 135x+162,5y=75,75( ** )
theo phương trình (4) ta có
nCu= nCuCl2=x(mol)
--> mCu= 64x (g)
theo phương trình (5) ta có
nFe=nFeCl3=y (mol )
--> mFe=56y (g)
theo bài ra ta có
64x+56y= 29,6 ( ** )
từ ( * ) và ( ** ) ta có hệ phương trình
\(\hept{\begin{cases}135x+162,5y=75,75\\64x+56y=29,6\end{cases}}\)
=> \(\hept{\begin{cases}x=0,2\\y=0,3\end{cases}}\)
=> mCuCl2= 0,2 x 135=27(g)
mFeCl3= 0,3 x 162,5= 48,75 (g)
LƯU Ý: bạn ghi ngoặc ở phép tính cuối và bạn tự giải phương trình hoặc liên hệ với mình

\(n_{Fe}=\frac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=\frac{250}{1000}.0,7=0,175\left(mol\right)\)
PTHH : Fe + 2HCl -----> FeCl2 + H2
(mol) 0,1 0,175 0,1
Ta có : \(\frac{n_{Fe}\left(\text{phản ứng}\right)}{n_{Fe}\left(\text{phương trình}\right)}=\frac{0,1}{1}>\frac{n_{HCl}\left(\text{phản ứng}\right)}{n_{HCl}\left(\text{phương trình}\right)}=\frac{0,175}{2}\)
Suy ra HCl phản ứng hết , Fe dư 0,1 - 0,175/2 = 0,0125(mol)
Fe + 2HCl ----> FeCl2 + H2
tính nFe =0,1 ; nHCl = 0,175
từ pt => Fe dư , HCl hết , nFe dư = 0,1 - 0,175/2=0,0125 mol
dd sau pu gồm Fe dư = 0,0125 , FeCl2= 0,175/2 = 0,0875 > CM = n/V ;
H2 + CuO ---> Cu + H2O
nH2 = 0,0875 ; nCuO = 0,2 , từ pt => CuO dư = 0,2 - 0,0875 = 0,1125 và Cu tạo thành = 0,0875 => khối lượng từng chất

nCa = mCa : MCa = 16:40= 0,4(mol)
PTHH Ca + O2 --------> (có t0 bạn nhé) CaO
Theo PTHH: 1 mol 1 mol 1 mol
Theo đề bài 0,4 mol 0,4 mol 0,4 mol
nHCl = mHCl : MHCl = 18,25 : (1+35,5) = 0,5 (mol)
PTHH CaO + 2HCl ------> CaCl2 + H2O
Theo PTHH 1 mol 2 mol 1 mol 1 mol
TPỨ 0,4 mol 0,5 mol ____ ______
PỨ 0,25 mol 0,5 mol 0,25 mol 0,25 mol
Tỉ lệ: CaO HCl
\(\dfrac{0,4}{1}\) \(\dfrac{0,5}{2}\)
0,4 > 0,25
=> CaO dư
Tính theo số mol HCl
Khối lượng của CaCl2 là:
\(m_{CaCl_2}=n_{CaCl_2}.M_{CaCl_2}=0.25.\left(40+35,5.2\right)=27,75\) (g)
Khối lượng của H2O là :
\(m_{H_{2^{ }}O}=n_{H_{2^{ }}O}.M_{H_{2^{ }}O}=0,25.\left(1\cdot2+16\right)=4,5\left(g\right)\)
nCa = mCa : MCa = 16:40= 0,4(mol)
PTHH Ca + O2 --------> (có t0 bạn nhé) CaO
Theo PTHH: 1 mol 1 mol 1 mol
Theo đề bài 0,4 mol 0,4 mol 0,4 mol
nHCl = mHCl : MHCl = 18,25 : (1+35,5) = 0,5 (mol)
PTHH CaO + 2HCl ------> CaCl2 + H2O
Theo PTHH 1mol 2mol 1mol 1mol
TPỨ 0,4 mol 0,5 mol ____ ______
PỨ 0,25 mol 0,5 mol 0,25 mol 0,25 mol
Tỉ lệ: CaO HCl
\(\dfrac{0,4}{1}\) \(\dfrac{0,5}{2}\)
0,4 > 0,25
=> CaO dư
Tính theo số mol HCl
Khối lượng của CaCl2 là:
mCaCl2=nCaCl2.MCaCl2=0.25.(40+35,5.2)=27,75
(g)
Khối lượng của H2O là :
mH2O=nH2O.MH2O=0,25.(1⋅2+16)=4,5(g)

Đáp án C
n F e = 0 , 56 / 56 = 0 , 01 m o l , n O 2 = 16 / 32 = 0 , 5 m o l

Từ phương trình hóa học xác định được sau phản ứng có oxi dư,
Khối lượng Fe3O4 thu được là: 0,01 3 .232 = 0,773 gam.

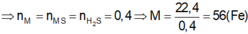
Tk
2Ca + O2 -> 2CaO (1)
CaO + 2HCl -> CaCl2 + H2O (2)
nCa=0,4(mol)
nHCl=0,5(mol)
Từ 1:
nCaO=nCa=0,4(mol)
Vì 0,4>0,52=0,250,4>0,52=0,25 nên sau PƯ 2 thì CaO dư 0,15 mol
Từ 2:
nCaCl2=1212nHCl=0,25(mol)
mCaCl2=111.0,25=27,75(g)
mCaO=56.0,15=8,4(g)
lớp mấy ấy nhỉ