X là kim loại hóa trị 2,hòa tan 6,082 g X trong HCL dư tạo thành 5,6L H2(dktc)a.Tìm nguyên tử khối của X b.X có 3 đồng vị tổng số khối 3 đồng vị là 75 X2=(X1+X3) chia cho 2 Đồn vị X1 có số p=số n X3 chiếm 11,4 %,X3 có số hạt nơ tron >đồng vị X2 là 1 hạt.Tìm a,n của X1,X2,X3.% số nguyên tử của X1,X2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án C
Gọi số khối của ba đồng vị tương ứng x1, x2, x3
Ta có x2= x1 +1
Theo đề ra ta có hệ phương trình
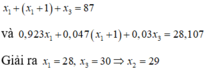

a.
X + 2HCl = XCl2 + H2
nX = nH2 = 5,6/22,4 = 0,25 mol
=> X = 6,082/0,25 = 24,328 (Mg)
b.
Mg có Z = 12
Gọi A1, A2, A3 lần lượt là số khối của 3 đồng vị
Tổng số khối của 3 đồng vị là 75
=> A1 + A2 + A3 = 75 (1)
Số khối của đồng vị thứ hai bằng trung bình cộng số khối của hai đồng vị kia
A2 = (A1 + A3)/2 => A1 - 2A2 + A3 = 0 (2)
Lấy (1) trừ (2) => 3A2 = 75 => A2 = 25 => N2 = A2 - Z = 25 - 12 = 13
Đồng vị thứ 3 có số neutron nhiều hơn đồng vị thứ 2 là 1 đơn vị
N3 - N2 = 1 => N3 = 1 + 13 = 14
=> A3 = 12 + 14 = 26
=> A1 = 75 - 26 - 25 = 24
Đồng vị 26Mg trong tự nhiên chiếm 11,4% số nguyên tử
=> %(24Mg, 25Mg) = 100% - 11,4% = 88,6%
Ta có : (88,6 - x)A1 + xA2 + 11,4A3 = 24,328.100
=> x = 10(%)
Vậy thành phần % của 3 đồng vị 24Mg, 25Mg và 26Mg lần lượt là
78,6%, 10% và 11,4%
c.
Giả sử có 100 nguyên tử Mg thì sẽ có
78,6 nguyên tử 24Mg ; 10 nguyên tử 25Mg ; 11,4 nguyên tử 26Mg
Vậy nếu có 50 nguyên tử 25Mg thì sẽ có
393 nguyên tử 24Mg và 57 nguyên tử 26Mg

Tổng số khối 3 đồng vị X1,X2,X3 là 87 nên ta có pt:
\(A_{X1}+A_{X2}+A_{X3}=87\left(1\right)\)
Vì X2 có nhiều hơn X1 là 1 hạt notron, nên ta có pt:
\(N_{X2}-N_{X1}=1\\ \Leftrightarrow A_{X2}-A_{X1}=1\left(2\right)\)
Mặt khác, khối lượng nguyên tử trung bình là 28,0855 đ.v.C nên ta có pt:
\(\dfrac{A_{X1}.92,23\%+A_{X2}.4,67\%+A_{X3}.3,1\%}{100\%}=28,0855\left(đ.v.C\right)\left(3\right)\)
Từ (1), (2), (3) ta lập được hệ 3pt và giải tìm nghiệm được:
\(\left\{{}\begin{matrix}A_{X1}\approx28\left(đ.v.C\right)\\A_{X2}\approx29\left(đ.v.C\right)\\A_{X3}\approx30\left(đ.v.C\right)\end{matrix}\right.\)
\(b.\left\{{}\begin{matrix}P_{X1}+N_{X1}=28\\P_{X1}=N_{X1}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}P_{X1}=14\\N_{X1}=14\end{matrix}\right.\\ \Rightarrow N_{X2}=29-14=15\left(hạt\right)\\ N_{X3}=30-14=16\left(hạt\right)\)

Vì phần trăm các đồng vị bằng nhau nên mỗi đồng vị chiếm 50%.
Vì các loại hạt trong X1 bằng nhau và X1 có tổng số hạt (gồm p, n, e) là 18
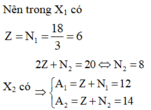
Vậy nguyên tử khối trung bình của X là:
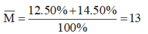
Đáp án D

Đáp án D.
X1 có tổng các loại hạt bằng = 18 và các hạt trong X1 bằng nhau
Ta có p + e + n = 18 mặt khác p = e =n
=> p = e = n =6
X2 có số hạt proton bằng số hạt proton trong X1 do cùng là đồng vị:
2p + n =20 => n = 8
Ta có số khối của X1 = 12, X2 = 14 và %X1 = %X2 = 50%.
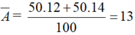

Đáp án D
Vì phần trăm các đồng vị bằng nhau nên mỗi đồng vị chiếm 50%.
Vì các loại hạt trong X1 bằng nhau và X1 có tổng số hạt (gồm p, n, e) là 18
Nên trong X1 có Z = N 1 = 18 3 = 6
X2 có 2 Z + N 2 = 20 ⇔ N 2 = 8 ⇒ A 1 = Z + N 1 = 12 A 2 = Z + N 2 = 14
Vậy nguyên tử khối trung bình của X là:
M
¯
=
12
.
50
%
+
14
.
50
%
100
%
=
13

Đáp án C
Đồng vị X1 có tổng số hạt là 18 → 2Z1 + N1 = 18
Trong X1 có các loại hạt bằng nhau
→ Z1= N1 =
18
3
= 6 → A1 = Z1 + N1 = 12
Đồng vị X2 có tổng số hạt là 20
→ 2Z2 + N2 = 20
Luôn có Z2=Z1 ( cùng là đồng vị của nguyên tố X)
→ Z2 = 6 → N2 = 8 → A2 = 6 + 8 = 14
Nguyên tử khối trung bình của X là
M X = ( 50 . 12 + 20 . 14 ) / 100 = 13