Đốt nóng hỗn hợp bột Fe và S thu được hợp chất sắt Sunfua. Biết hai nguyên tố này kết hợp với nhau theo tỉ khối là 7 phần sắt và 4 phần lưu huỳnh. Tìm công thức hóa học đơn giản của sắt sunfua.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Giả sử hợp chất có khối lượng 7g → m M g = 3g ; m S = 4g
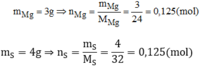
Vậy trong hợp chất: 0,125 mol nguyên tử Mg và 0,125 mol nguyên tử S. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử S.
Nên công thức hóa học đơn giản của magie sunfua: MgS.

a) CTTQ MgxSy (x,y: nguyên, dương)
Ta có: mMg/ mS= 3/4
<=> 24x/32y=3/4
<=>x/y=1/1
=> CTHH đơn giản: MgS
b) nMg= 1/3 (mol)
nS= 0,25(mol)
PTHH: Mg + S -to-> MgS
Ta có: 1/3 : 1 > 0,25/1
=> Mg dư, S hết, tính theo nS
=> nMgS=0,25(mol) -> mMgS= 56.0,25=14(g)
mMg(dư)= 8 - 0,25.24=2(g)
=> Chọn D

Giả sử hợp chất có khối lượng 7g → m M g = 3g ; m S = 4g
Chọn D. Vì:
Theo đề bài: 3g Mg kết hợp vừa đủ với 4g S.
Hoặc 6g Mg kết hợp vừa đủ với 8g S.
Nếu trộn 8g Mg với 8g S thì sẽ sinh ra 14g MgS và còn dư 2g Mg.

TL
Đun nóng hỗn hợp bột sắt và lưu huỳnh thu được hợp chất sắt(II)sunfua. Phương trình chữ của phản ứng là
A. Sắt + Sắt (II) sunfua → lưu huỳnh
B. Sắt + lưu huỳnh → Sắt (II) sunfua
C. Sắt → lưu huỳnh + sắt (II) sunfua
D. Lưu huỳnh + Sắt (II) sunfua → Sắt Giúp tớ với
HT Ạ
Đun nóng hỗn hợp bột sắt và lưu huỳnh thu được hợp chất sắt(II)sunfua. Phương trình chữ của phản ứng là
A. Sắt + Sắt (II) sunfua → lưu huỳnh
B. Sắt + lưu huỳnh → Sắt (II) sunfua c
. Sắt → lưu huỳnh + sắt (II) sunfua
D. Lưu huỳnh + Sắt (II) sunfua → Sắt Giúp tớ với

\(PTHH:Fe+S-^{t^o}>FeS\)
BD 0,21875 0,3125
PU 0,21875--> 0,21875---> 0,21875
CL 0----------->0,09375--->0,2175
\(n_{Fe}=\dfrac{m}{M}=\dfrac{14}{64}=0,21875\left(mol\right)\)
\(n_S=\dfrac{m}{M}=\dfrac{10}{32}=0,3125\left(mol\right)\)
\(\dfrac{n_{Fe}}{1}< \dfrac{n_S}{1}\left(\dfrac{0,21875}{1}< \dfrac{0,3125}{1}\right)\)
=> Fe hết , S dư
\(m_S=n\cdot M=\text{0,09375}\cdot32=3\left(g\right)\)
làm lại (suy ngẫm lại thì mik sai)
\(PTHH:Fe+S-^{t^o}>FeS\)
áp dụng ĐLBTKL ta có
\(m_{Fe}+m_S=m_{FeS}\)
\(=>m_S=m_{FeS}-m_{Fe}\\ =>m_S=22-14\\ =>m_S=8\left(g\right)\)
khối lượng lưu huỳnh đã lấy là
\(10-8=2\left(g\right)\)

Theo định luật bảo toàn khối lượng, ta có công thức khối lượng của phản ứng:
m F e + m S = m F e S
Khối lượng lưu huỳnh đã hóa hợp với sắt là:
m S = m F e S - m F e = 44 – 28 = 16(g)
Khối lượng lưu huỳnh lấy dư: 20 – 16 = 4 (g)

\(n_{FeS}=\dfrac{44}{88}=0,5\left(mol\right)\)
PTHH: Fe + S --to--> FeS
0,5 0,5
\(m_{S\left(dư\right)}=20-32.0,5=4\left(g\right)\)

theo định luật bảo toàn khối lượng, ta có công thức khối lượng của phản ứng: mfe + ms = mfes khối lượng lưu huỳnh đã hóa hợp với sắt là: ms = mfes – mfe = 44 – 28 = 16(g) khối lượng lưu huỳnh lấy dư: 30 – 16 = 14 (g)
Gọi CTHHTQ của hc sắt sunfua là FexSy
Ta có :
\(\dfrac{mFe}{mS}=\dfrac{7}{4}< =>\dfrac{56x}{32y}=\dfrac{7}{4}< =>\dfrac{x}{y}=\dfrac{56.4}{32.7}=\dfrac{1}{1}\)
=> CTHH là FeS