a) Viết các phương trình hóa học điều chế H2SO4 từ quặng pirit sắt FeS2 theo sơ đồ chuyển hóa sau:
\(FeS_2\rightarrow SO_2\rightarrow SO_3\rightarrow H_2SO_4\)
b) Từ 1,2 tấn quặng có chứa 90% FeS2 ( về khối lượng ),có thể sản xuất được bao nhiêu tấn H2SO4 96% ?.Biết rằng hiệu suất của quá trình sản xuất là 85%.
P/s: Giúp mình câu b thôi,dùng phương pháp bảo toàn nguyên tố nha.|Trong sách họ giải quá ngắn=>ko hiểu.

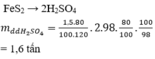
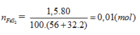
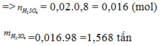

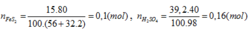
a) 4FeS2 + 11O2 ––> 2Fe2O3 + 8SO2
2SO2 + O2 -----(tº)------> 2SO3
SO3 + H2O ––> H2SO4
Trên thực tế, SO3 cũng bị hấp thụ bởi H2SO4 để tạo ra ôleum (H2S2O7), chất này sau đó bị làm loãng để tạo thành axít sulfuric.
H2SO4 + SO3 → H2S2O7
Ôleum sau đó phản ứng với nước để tạo H2SO4 đậm đặc.
H2S2O7+ H2O → 2 H2SO4
b) 1.2 tấn= 1200000g
mFeS2= 1200000*90%=1080000g
=>nFeS2=1080000/120=9000 mol
Ta có sơ đồ : FeS2 ---> 2SO2 -->2SO3 --> 2H2SO4
9000 mol 18000 mol
Theo định luật bảo toàn nguyên tố:
nH2SO4= 18000*85%=15300 mol
=>mH2SO4= 15300*98= 1499400g
Theo đề C%= 96%
=>mddH2SO4=1499400*100/96=1561875g=1.561875 tấn
Số khủng khiếp quá, bạn xem lại giúp tôi nhé. tôi tính hơi nhanh :)
thanks.