Bài 1. Hỗn hợp A gồm đồng (II) oxit và sắt (III) oxit, trong đó sắt (III) oxit chiếm 80% khối lượng Tính khối lượng khí H2 cần thiết để khử hoàn toàn 50 gam A.Bài 2. Cho 13 gam kẽm tác dụng hoàn toàn với dung dịch có 0,3 mol axit HCl, thu được m gam ZnCl2 và V lít khí hiđro (đktc). Tính m, V.Bài 3: Cho 6 gam magie tác dụng với dung dịch H2SO4 (loãng). a. Tính thể tích khí hiđro (đktc) thu được, biết hiệu suất phản ứng...
Đọc tiếp
Bài 1. Hỗn hợp A gồm đồng (II) oxit và sắt (III) oxit, trong đó sắt (III) oxit chiếm 80% khối lượng Tính khối lượng khí H2 cần thiết để khử hoàn toàn 50 gam A.
Bài 2. Cho 13 gam kẽm tác dụng hoàn toàn với dung dịch có 0,3 mol axit HCl, thu được m gam ZnCl2 và V lít khí hiđro (đktc). Tính m, V.
Bài 3: Cho 6 gam magie tác dụng với dung dịch H2SO4 (loãng).
a. Tính thể tích khí hiđro (đktc) thu được, biết hiệu suất phản ứng là 90%.
b. Nếu dùng lượng H2 ở trên để khử hoàn toàn 11,2 gam sắt (III) oxit, thu được tối đa bao nhiêu gam sắt?
Bài 4: Cần dùng m gam khí H2 để khử hết 22,3 gam PbO (hiệu suất phản ứng là 80%). Tính m.
Bài 5: Dùng khí H2 khử 11,2 gam sắt (III) oxit thành Fe. Tính khối lượng Fe thu được, biết hiệu suất phản ứng là 90%.
Bài 6: Cho m gam khí H2 đi từ từ qua 64 gam CuO đun nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được 57,6 gam chất rắn A. Tính % khối lượng các chất trong A.
Bài 7. Cho 7,5 gam hỗn hợp X gồm Al và Mg tác dụng hoàn toàn với dung dịch HCl dư.
a. Tính khối lượng muối AlCl3; MgCl2 thu được sau phản ứng. Biết nhôm chiếm 36% khối lượng hỗn hợp X.

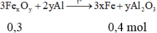
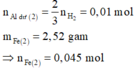

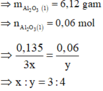
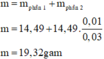
Bài 2
MNa2CO3.xH2O = 106+18x
Vì % MNa2CO3 = 37,07% =106 (g/mol)
=> \(\dfrac{106}{106+18x}=37,07\%\)
<=> 106=39,2942+6,6726x
<=> x \(\approx10\)
Vậy x=10
Bài 1 :
PTHH:
\(A+O_{2\left(dư\right)}-->H_2SO_4.n_{SO_3}\)
Vì hỗn hợp A gồm H2, H2S và SO2 có tỷ lệ mol 1:2:3 .
Gỉa sử số mol các chất đó là \(x;2x;3x\)
\(=>n_H=6x;n_S=5x\)
Ta có, theo công thức Oleum :
\(n_H:n_S=2:\left(x+1\right)=6x:5x\)
\(=>x=\dfrac{2}{3}\)
Vậy Y là \(3H_2SO_4.2SO_3\)