a) Định nghĩa nguyên tố hoá học.
b) Kí hiệu nguyên tử thể hiện những đặc trưng gì cho nguyên tử một nguyên tô' hoá học, lấy thí dụ với nguyên tố kali.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Kí hiệu nguyên tử: 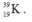
Kí hiệu trên cho ta biết:
Số hiệu nguyên tử của nguyên tố K là 19, số đơn vị điện tích hạt nhân nguyên tử là 19, trong hạt nhân có 19 proton và (39 – 19 = 20) notron. Vỏ electron của nguyên tử K có 19 electron.
Nguyên tử khối của K là 39u.

a) Nguyên tố hoá học bao gồm các nguyên tử có cùng sô đơn vị điện tích hạt nhân.
b) Kí hiệu nguyên tử 19 K.
Kí hiệu trên cho ta biết: Số hiệu nguyên tử của nguyên tố K là 19, số đơn vị điện tích hạt nhân nguyên tử là 19, trong hạt nhân có 19 proton và (39 - 19 = 20) nơtron. Vỏ electron của nguyên tử K có 19 electron.
Nguyên tử khối của K là 39u.
a) Nguyên tô hoá học bao gồm các nguyên tử có cùng sô đơn vị điện tích hạt nhân.
b) Kí hiệu nguyên tử 19 K.
Kí hiệu trên cho ta biết: Số hiệu nguyên tử của nguyên tố K là 19, số đơn vị điện tích hạt nhân nguyên tử là 19, trong hạt nhân có 19 proton và (39 - 19 = 20) nơtron. Vỏ electron của nguyên tử K có 19 electron.
Nguyên tử khối của K là 39u.

Chọn D
Kí hiệu nguyên tử cho biết số khối A và số hiệu nguyên tử Z.

Các nguyên tử của một NTHH có tích chất hóa học như nhau và có cùng số proton trong hạt nhân
Nguyên tố hóa học là : tập hợp các nguyên tử cùng loại và có cùng số proton trong hạt nhân.
natri Na : p=e=11
magine Mg ; p=e=12
sắt Fe : p=e=26
clo Cl : p=e=17

4 - D
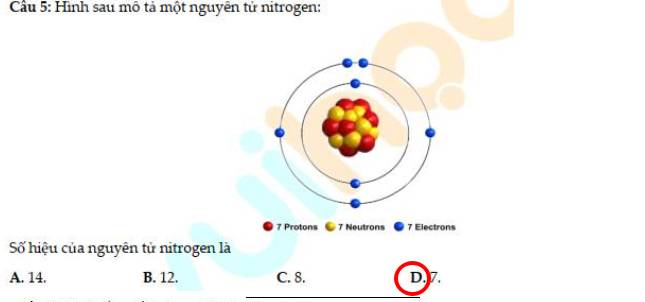

Vì 1 nguyên tử S có khối lượng là 32 amu
`=>` 3 nguyên tử S có khối lượng là: `32 * 3 = 96 (am``u)`
Vì 4 nguyên tử x và 3 nguyên tử S bằng nhau
`=> 4*x = 96`
`=> x = 24`
Vậy, khối lượng `1` nguyên tử x là `24` amu`
`=>` X là Magnesium

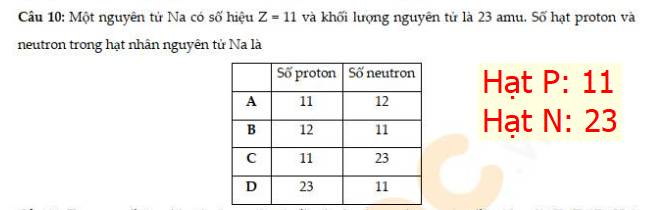
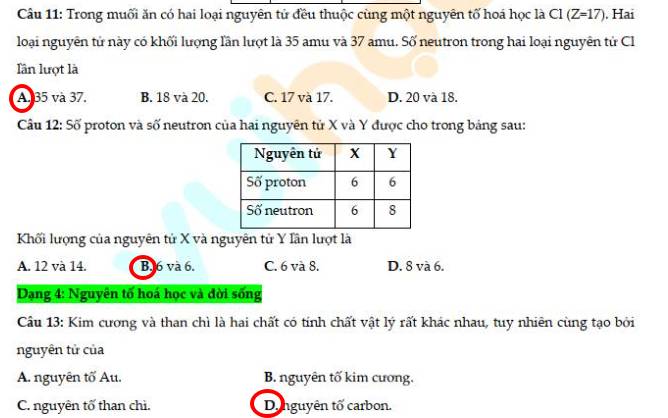
14 - B
- Nước có CTHH là \(\text{H}_2\text{O}\), được tạo bởi 2 nguyên tử nguyên tố Hydrogen và Oxygen.
15 - D
- Na là kí hiệu HH của nguyên tử nguyên tố Sodium (Natri)
- K là kí hiệu HH của nguyên tử nguyên tố Potassium (Kali).

a) A có 8 electron, 8 proton
b) Câu hình e: 1s22s22p4
=> A có 6e lớp ngoài cùng
=> A có tính chất của phi kim
c)
- A là O (oxi)
- Trong chu kì 2, 2 nguyên tố lân cận với O là N, F
Trong 1 chu kì, theo chiều tăng điện tích hạt nhân, tính phi kim tăng dần
=> N < O < F (Xét theo tính phi kim)
- Trong nhóm VIA, nguyên tố lân cận với O là S
Trong 1 nhóm A, theo chiều tăng điện tích hạt nhân, tính phi kim giảm dần
=> O > S (Xét theo tính phi kim)
a: Do A có Z=8 nên A là oxi
Cấu tạo nguyên tử là \(O=O\)
b: Tính chất hóa học đặc trưng là tính phi kim, có tính oxi hóa mạnh

Đối với các nguyên tố thuộc các nhóm A thì những electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tố tương ứng.
Các electron ở lớp ngoài cùng có khả năng, tham gia hình thành liên kết hoá học được gọi là các electron hoá trị.
Thí dụ, cacbon có cấu hình electron : 1 s 2 2 s 2 2 p 2 , các electron 2 s 2 2 p 2 là những electron lớp ngoài cùng và là những electron hoá trị.
a) Nguyên tố hoá học bao gồm các nguyên tử có cùng sô đơn vị điện tích hạt nhân.
b) Kí hiệu nguyên tử 19 K.
Kí hiệu trên cho ta biết: Số hiệu nguyên tử của nguyên tố K là 19, số đơn vị điện tích hạt nhân nguyên tử là 19, trong hạt nhân có 19 proton và (39 - 19 = 20) nơtron. Vỏ electron của nguyên tử K có 19 electron.
Nguyên tử khối của K là 39u.