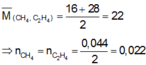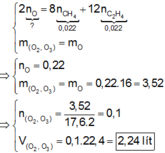hỗn hợp X gồm CH4 và H2 có khối lượng 2,2 gam.tỉ khối của hỗn hợp X so với hidro là 2,75 .trộn V lít khí O2 với 2,2 gam hỗn hợp khí X thì được hôn hợp khí Y .tỉ khối của hỗn hợp Y so với hidro là 9,375 .cung cấp nhiệt để thực hiện phản ứng cháy hỗn hợp Y ,phản ứng xong làm lạnh hỗn hợp sản phẩm thì thu được hỗn hợp khí Z .
a) Tính V
b) Xác định thành phần phần trăm thể tích mỗi khí trong X,Y,Z.