Trộn a(g) Fe vs b(g) S rồi nung nóng ở nhiệt độ cao (ko có không khí) . Hòa tan hh sau Pư =dd HCl dư thu dc chrắn A nặng 0,4g ; khí C có d C/H2 = 9.Cho khí C sục từ từ wa dd Pb(NO3)2 thu đc 11,95g kết tủa .
a. tính a,bb. tính H của Fe , S.Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi x,y là số mol Fe phản ứng, Fe dư
Fe+S\(\rightarrow\)FeS
.x.....x.........x
FeS+2HCl−−−>FeCl2+H2S
.....x....................................x
Fe+2HCl−−−>FeCl2+H2
...y................................y
H2S+Pb(NO3)2−−−>PbS\(\downarrow\)+2HNO3
0,1..............................0,1........
Ta có: \(\dfrac{34x+2y}{x+y}\)=18
=> x=y=0,1
m\(_{Fe}\)bđ=m\(_{Fe}\) pứ + m\(_{Fe}\) dư =0,1.2.56=11,2(g)
m\(_S\)bđ=m\(_S\) pứ + m\(_S\) dư =0,1.32+0,8=4(g)

hòa tan hoàn toàn khối lượng Fe và Cu(tỉ lệ 1:1) bằng axit HNO3 thu được V lít hỗn hợp khí X gồm NO và NO2 và dung dịch Y (chỉ chứa 2 muốivà axit ) tỉ khối của X đối với H2 bằng 19. tính V
các bạn giải theo cách bảo toàn electron nha
a) Ta có: nH2 = 1,008/22.4 = 0,045 \(\rightarrow\) nHCl = 0,045 x 2= 0,09mol
mA = mmuối - mCl = 4,575 - 0,09 x 35,5 = 1,38g
Đặt x, y lần lượt là số mol của Fe, M và n là hóa trị của M trong hợp chất. Từ 2 phương trình ta có:
56x + My = 1,38 (1)
2x + ny = 0,09 (2)
b) Ở câu b này mình cho rằng đó là H2SO4 đặc chứ ko phải loãng vì nếu loãng thì ta ko thu được hh khí có tỉ khối hơi như vậy.
Các phương trình phản ứng:
Fe + 6HNO3 \(\rightarrow\) Fe(NO3)3 +3NO2 + 3H2O
M + 2nHNO3\(\rightarrow\) M(NO3)n + nNO2 + nH20
2Fe + 6H2SO4 \(\rightarrow\) Fe2(SO4)3 + 3SO2 + 6H2O
2M + 2nH2SO4 \(\rightarrow\) M2(SO4)n + nSO2 + 2nH2O
Ta có: dkhí/ H2 =25,25 \(\rightarrow\) Mkhí = 50,5
Số mol 2 khí=1,8816:22,4=0,084mol
lập hệ giải ra: nNO2 = 0,063, nSO2 = 0,021
Ta có các phương trình e như sau:
Fe \(\rightarrow\) Fe3+ + 3e
x---------------3x
M \(\rightarrow\) Mn+ + ne
y--------------ny
N5+ + 1e \(\rightarrow\) N4+
0,063 \(\leftarrow\) 0,063
S6+ + 2e\(\rightarrow\) S4+
0,042 \(\leftarrow\) 0,021
Tổng e nhận = tổng e nhường nên :
3x + ny = 0,063 + 0,042 = 0,105
kết hợp với (2) suy ra được x = 0,015
ny = 0,06 \(\rightarrow\) y = 0,06/n
Thay vào (1) \(\rightarrow\) M = 9n
Biện luận thì tìm được M là Al.

Các bạn làm ơn giúp mình mình đang cần rất gấp mình cmar ơn các bạn rất nhiều
bài 2
+) TH1 : nNaOH ≥ 2.nCO2 => OH- dư
=> nCO3 = nCO2
+) TH2 : nCO2 < nNaOH < 2.nCO2 => Sinh ra 2 muối CO32- và HCO3-
=> nCO3 = nOH – nCO2
+) TH3 : nCO2 > nNaOH => CO dư => sinh ra muối HCO3-.
=> nHCO3 = nNaOH
K + H2O -> KOH + ½ H2
Ba + 2H2O -> Ba(OH)2 + H2
=> nK.0,5 + nBa = nH2 = 0,25 mol
Và : mK + mBa = 31,3g
=> nK = 0,1 ; nBa = 0,2 mol
Vậy dung dịch X có : 0,1 mol KOH ; 0,2 mol Ba(OH)2
X + CO2 (0,4 mol)
Có : nCO2 < nOH = 0,5 mol < 2.nCO2
=> nCO3 = nOH – nCO2 = 0,1 mol < nBa2+ = 0,2 mol
Vậy kết tủa là 0,1 mol BaCO3
=> m = 19,7g

Câu 2.2:
a,\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2K + 2H2O → 2KOH + H2
Mol: x 0,5x
PTHH: Ba + 2H2O → Ba(OH)2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}39x+137y=31,3\\0,5x+y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_K=0,1.39=3,9\left(g\right);m_{Ba}=0,2.137=27,4\left(g\right)\)

a, PT: \(Fe+S\underrightarrow{t^o}FeS\)
Ta có: \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,1}{1}\), ta được Fe dư.
Chất rắn A gồm Fe dư và FeS.
Theo PT: \(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,2\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2}=n_{Fe\left(dư\right)}=0,2\left(mol\right)\\n_{H_2S}=n_{FeS}=0,1\left(mol\right)\end{matrix}\right.\)
Ở cùng điều kiện nhiệt độ và áp suất, %V cũng là % số mol.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,2}{0,2+0,1}.100\%\approx66,67\%\\\%V_{H_2S}\approx33,33\%\end{matrix}\right.\)
b, Ta có: \(\Sigma n_{HCl\left(dadung\right)}=2n_{Fe}+2n_{FeS}=0,6\left(mol\right)\) (1)
PT: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(n_{NaOH}=0,1.2=0,2\left(mol\right)\)
\(\Rightarrow n_{HCl\left(dư\right)}=n_{NaOH}=0,2\left(mol\right)\) (2)
Từ (1) và (2) \(\Rightarrow\Sigma n_{HCl}=0,8\left(mol\right)\)
\(\Rightarrow C_{M_{ddHCl}}=\dfrac{0,8}{0,5}=1,6\left(M\right)\)
Bạn tham khảo nhé!

\(n_{H2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,05 0,1 0,05 0,05
\(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,2 0,4 0,2
a) \(n_{Mg}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
\(m_{Mg}=0,05.24=1,2\left(g\right)\)
\(m_{MgO}=9,2-1,2=8\left(g\right)\)
0/0Mg = \(\dfrac{1,2.100}{9,2}=13,04\)0/0
0/0MgO = \(\dfrac{8.100}{9,2}=86,96\)0/0
b) Có : \(m_{MgO}=8\left(g\right)\)
\(n_{MgO}=\dfrac{8}{40}=0,2\left(mol\right)\)
\(n_{HCl\left(tổng\right)}=0,1+0,4=0,5\left(mol\right)\)
\(m_{HCl}=0,5.36,5=18,25\left(g\right)\)
\(m_{ddHCl}=\dfrac{18,25.100}{14,6}=125\left(g\right)\)
c) \(n_{MgCl2\left(tổng\right)}=0,05+0,2=0,25\left(mol\right)\)
⇒ \(m_{MgCl2}=0,25.95=23,75\left(g\right)\)
\(m_{ddspu}=9,2+125-\left(0,05.2\right)=134,1\left(g\right)\)
\(C_{MgCl2}=\dfrac{23,75.100}{134,1}=17,71\)0/0
Chúc bạn học tốt
a)\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: 0,05 0,1 0,05 0,05
PTHH: MgO + 2HCl → MgCl2 + H2O
Mol: 0,2 0,4 0,2
\(\%m_{Mg}=\dfrac{0,05.24.100\%}{9,2}=13,04\%;\%m_{MgO}=100-13,04=86,96\%\)
\(n_{MgO}=\dfrac{9,2-0,05.24}{40}=0,2\left(mol\right)\)
b,\(m_{HCl}=\left(0,1+0,4\right).36,5=18,25\left(g\right)\)
\(m_{ddHCl}=\dfrac{18,25.100}{14,6}=125\left(g\right)\)
c,mdd sau pứ = 9,2+125-0,05.2 = 134,1 (g)
\(C\%_{ddMgCl_2}=\dfrac{\left(0,05+0,2\right).95.100\%}{134,1}=17,71\%\)

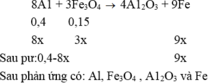
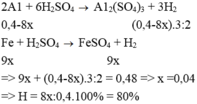
a) chất rắn A là S dư. khí C gồm có H2S và H2 ( dùng đường chéo sẽ tìm đc tỉ lệ số mol là 1 : 1)
Fe + S →→ FeS 0,05 0,05 0,05FeS + 2HCl ----> FeCl2 + H2S0,05 0,05Fe(dư) + 2HCl ----> FeCl2 + H20,05 0,05H2S + Pb(NO3)2 ----> PbS + 2HNO30,05 0,05số mol của S = 0,05 + \(\frac{0,4}{32}\) = 0,0625 molsố mol của Fe = 0,05 + 0,05 =0,1 mol P/s: bạn tự tìm a, b nhé ^_^b) vì số mol của S < số mol của Fe => bạn sẽ tính H theo Stừ pt đầu tiên bạn lm hết dư sẽ tìm đc số mol Fe dư là 0,0375H = \(\frac{0,0375}{0,1}\) . 100 = 37,5 (%)