Tại sao các phản ứng giữa dung dịch axit và hiđroxit có tính bazơ và phản ứng giữa muối cacbonat và dung dịch axit rất dễ xảy ra?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Sản phẩm của phản ứng giữa dung dịch axit và hiđroxit bazơ là muối và nước (H2O), mà nước là chất điện li yếu.
Ví dụ: Mg(OH)2 + 2HCl → MgCl2 + 2H2O
- Sản phẩm của phản ứng giữa muối cacbonat và dung dịch axit là muối mới, và axit cacbonic (H2CO3) rất yếu, dễ dàng bị phân huỷ thành nước (H2O và khí cacbonic (CO2) Vậy sản phẩm cuối cùng sau phản ứng có chất dễ bay hơi (CO2) và chất điện li yếu (H2O).
Ví dụ: CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
- Theo điều kiện của phản ứng trao đổi thì phản ứng trên xảy ra được.

Phản ứng giữa dung dịch axit và hiđroxit có tính bazơ rất dễ xảy ra vì có sự tạo thành chất điện li rất yếu là H2O Ví dụ: Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Phản ứng giữa muối cacbonat và dung dịch axit dễ xảy ra vì có sự tạo thành chất khí là CO2
Ví dụ: Na2CO3 + 2HCl → 2NaCl + CO2 ↑+ H2O

Phản ứng giữa dung dịch axit và hiđroxit có tính bazơ rất dễ xảy ra vì có sự tạo thành chất điện li rất yếu là H2O Ví dụ: Mg(OH)2 + 2HCl \(\rightarrow\) MgCl2 + 2H2O
Phản ứng giữa muối cacbonat và dung dịch axit dễ xảy ra vì có sự tạo thành chất khí là CO2
Ví dụ: Na2CO3 + 2HCl \(\rightarrow\) 2NaCl + CO2 \(\uparrow\)+ H2O

Phương trình hoá học ở dạng phân tử và dạng ion rút gọn của các phản ứng xảy ra trong dung dịch :
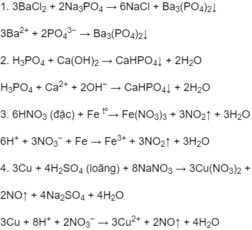

Chọn D.
Kim loại sau H trong dãy hđ kim loại ko phản ứng được với HCl

\(n_{NaOH}=C_M.V=0,3\left(mol\right)\)
\(n_{Na2CO3}=\dfrac{m}{M}=0,1\left(mol\right)\)
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
..0,15...........0,3.............0,15............
\(H_2SO_4+Na_2CO_3\rightarrow Na_2SO_4+H_2O+CO_2\)
...0,1............0,1..............0,1...............
\(TheoPTHH:n_{H2SO4}=0,1+0,15=0,25\left(mol\right)\)
\(\Rightarrow C_{MH2SO4}=\dfrac{n}{V}=1M\)
- Thấy sau các phản ứng xảy ra thu được muối Na2SO4 ( 0,25mol )
=> mM = n.M = 35,5g

PTHH: \(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Ba\left(OH\right)_2}=0,05\cdot0,5=0,025\left(mol\right)\\n_{HCl}=0,15\cdot0,1=0,015\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,025}{1}>\dfrac{0,015}{2}\) \(\Rightarrow\) Ba(OH)2 còn dư, dd sau p/ứ có tính kiềm
\(\Rightarrow\left\{{}\begin{matrix}n_{BaCl_2}=0,0075\left(mol\right)\\n_{Ba\left(OH\right)_2\left(dư\right)}=0,0175\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C_{M_{BaCl_2}}=\dfrac{0,0075}{0,05+0,15}=0,0375\left(M\right)\\C_{M_{Ba\left(OH\right)_2}}=\dfrac{0,0175}{0,2}=0,0875\left(M\right)\end{matrix}\right.\)

Phương trình các phản ứng tạo ra bazơ và axit:
2Na + 2H2O → 2NaOH + H2.
Na2O + H2O → 2NaOH.
SO3 + H2O → H2SO4.
P2O5 + 3H2O → 2H3PO4.
* Nhận biết dung dịch axit:
- Quỳ tím hóa đỏ.
- Tác dụng với kim loại, muối cacbonat có khí bay lên.
* Nhận biết dung dịch bazơ:
- Quỳ tím hóa xanh.
- Phenolphtalein không màu chuyển sang màu hồng.
Phản ứng giữa dung dịch axit và hiđroxit có tính bazơ rất dễ xảy ra vì có sự tạo thành chất điện li rất yếu là H2O Ví dụ: Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Phản ứng giữa muối cacbonat và dung dịch axit dễ xảy ra vì có sự tạo thành chất khí là CO2
Ví dụ: Na2CO3 + 2HCl → 2NaCl + CO2 ↑+ H2O
Có thể hiểu thế này nhé
Túm lại: ĐK để một phản ứng trao đổi xảy ra thu về 1 trong 2 ĐK: có chất bay hơi, hoặc điện ly yếu (kết tủa là 1 trường hợp riêng). Đây giống như một kiểu chơi chữ ấy mà .
.
Ps: cần nói thêm rằng tại sao xảy ra một trong 2 đk trên là pứ xảy ra?
vì khi đó sp được tách ra khỏi dung dịch, do đó không còn cơ hội tác dụng ngược trở lại theo chiều nghịch nữa.
OK?
Chúc bạn học tốt. Vào đại học rồi sẽ còn nhiều cái quái dị hơn nhiều. Ví dụ: CMR: x + (-x) = :-SS0