Cho thanh kẽm vào 100ml dd FeSO4 có nồng độ a M, sau khi kết thúc phản ứng, lấy thanh kẽm rửa nhẹ, sấy khô và cân thì thanh kẽm giảm 2,25gam. Tính nồng độ mol FeSO4 đem dùng ( hóa 8 )
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PT: \(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\)
_____x_______2x__________x______2x (mol)
Ta có: m thanh kẽm tăng = mAg - mZn
⇒ 19,775 - 16 = 108.2x - 65x
⇒ x = 0,025 (mol)
a, mZn (pư) = 0,025.65 = 1,625 (g)
mAg = 0,025.2.108 = 5,4 (g)
b, Ta có: m dd AgNO3 = 80.1,1 = 88 (g)
\(\Rightarrow m_{AgNO_3}=88.10\%=8,8\left(g\right)\Rightarrow n_{AgNO_3}=\dfrac{8,8}{170}=\dfrac{22}{425}\left(mol\right)\)
\(\Rightarrow n_{AgNO_3\left(dư\right)}=\dfrac{22}{425}-0,025.2=\dfrac{3}{1700}\left(mol\right)\)
Có: m dd sau pư = 1,625 + 88 - 5,4 = 84,225 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{AgNO_3}=\dfrac{\dfrac{3}{1700}.170}{84,225}.100\%\approx0,36\%\\C\%_{Zn\left(NO_3\right)_2}=\dfrac{0,025.189}{84,225}.100\%\approx5,61\%\end{matrix}\right.\)


Theo (1) có khối lượng Cu bám vào: mCu = 0,4.2,5.64 = 64 (gam)
Theo (2) có khối lượng Cu bám vào: mCu = 0,4.64 =25,6 (gam).
Đáp án A

PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
chúc bạn học tốt và nhớ tích đúng cho mình

\(a.Zn+CuSO_4->ZnSO_4+Cu\)
b. m Zn giảm vì sau phản ứng tạo Cu (M = 64), M(Cu) < M(Zn) = 65 nên khối lượng lá Zn tăng.
\(m_{Zn\left(Pư\right)}=65x\left(g\right)\\ m_{Cu}=64x\left(g\right)\\c.\Delta m_{rắn}=25-24,96=65x-64x\\ x=0,04mol\\ m_{Zn\left(Pư\right)}=65x=2,6g< 25g\Rightarrow Zn:hết\\d. n_{CuSO_4}=160x=6,4g\)

Dạng bài toán cho kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch muối của chúng có hai trường hợp sau
+ Nếu đề bài cho khối lượng thanh kim loại tăng, lập phương trình đại số :
m kim loại giải phóng - m kim loại tan = m kim loại tăng
+ Nếu đề bài cho khối lượng thanh kim loại giảm, lập phương trình đại số :
m kim loại tan - m kim loại giải phóng = m kim loại giảm
Gọi x là số mol Zn tham gia
65x - 64x = 25 - 24,96 => x = 0,04 mol
m Zn p / u = 0,04 x 65 = 2,6 g
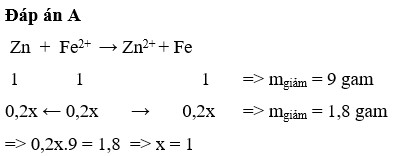
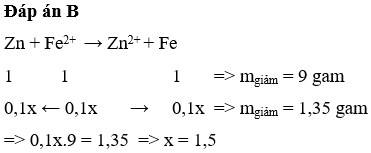
tăng giảm khối lượng...có mol FeSO4=2,25/(65-56)=0.25(mol)
=> a=2,5M