Tính lượng axit H2SO4 thu đc từ 60 kg quặng pirit nếu PỨ là 85% so vs lý thuyết
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Điều chế H2SO4 từ FeS2 qua các dãy biến hóa sau:
FeS2 -> 2SO2 -> 2SO3 -> 2H2SO4
120kg....................................2x98 kg
60kg.....................................98kg
Theo lý thuyết khối lượng H2SO4 sinh ra là 98 kg, nhưng hiệu suất 85% nên thực tế chỉ thu đc:
(98 x 85 ) : 100 = 83,3 kg
Khối lượng dd H2SO4 96% thu đc là:
100 kg dd có 96 kg H2SO4
x kg dd có 83,3 kg
=> x = (83,3 . 100 ) : 96 = 86,77 kg
b) Lượng S trong 80 tấn quặng pirit
(40 . 80) : 100 = 32 tấn
Điều chế H2SO4 từ S qua dãy biến hóa sau:
S -> SO2 -> SO3 -> H2SO4
32 tấn.......................98 tấn
Nếu tính theo lý thuyết ta thu đc 98 tấn H2SO4
Vậy hiệu suất của quá trình là: (92 x 100) : 98 = 93,88 %

a) Điều chế H2SO4 từ FeS2 qua các dãy biến hóa sau:
FeS2 -> 2SO2 -> 2SO3 -> 2H2SO4
120kg....................................2x98 kg
60kg.....................................98kg
Theo lý thuyết khối lượng H2SO4 sinh ra là 98 kg, nhưng hiệu suất 85% nên thực tế chỉ thu đc:
(98 x 85 ) : 100 = 83,3 kg
Khối lượng dd H2SO4 96% thu đc là:
100 kg dd có 96 kg H2SO4

lượng axit thu được là 86.77 g
lượng axit nguyên chất là 83.3 g
số mol SO2 = SO3 = H2SO4 là 0.85 mol
số g FeS2 pư là 51g, tính theo Hiệu suất của chất tham gia pư
PTHH : 4FeS2 + 11O2 -----> 2Fe2O3 + 8SO2
2SO2 + O2 ----> 2SO3 (xt:V2O5)
SO3 + H2O -----> H2SO4

\(m_{FeS_2}=45-45.20:100=36kg\\ FeS_2\rightarrow H_2SO_4\\ \Rightarrow2n_{FeS_2}=n_{H_2SO_4\left(lt\right)}\\ \Rightarrow2\cdot\dfrac{36}{120}=\dfrac{m_{H_2SO_4\left(lt\right)}}{98}\\ \Rightarrow m_{H_2SO_4\left(lt\right)}=58,8kg\\ m_{H_2SO_4\left(tt\right)}=58,8.60:100=35,28kg\\ m_{H_2SO_4,70\%}=35,28.100:70=50,4kg\)

\(FeS_2+18HNO_3\rightarrow7H_2O+2H_2SO_4+15NO_2+Fe\left(NO_3\right)_3\)
120g 196g
57kg ?
Khối lượng của FeS2 có trong 60kg quặng pirit là:
\(m_{FeS_2}=\dfrac{60\cdot95}{100}=57\left(kg\right)\)
Khối lượng của \(H_2SO_4\) thu được là:
\(m_{H_2SO_4}=\dfrac{57\cdot196}{120}=93,1\left(kg\right)\)
Vì hiệu suất đạt 85%
\(\Rightarrow m_{H_2SO_4\left(tt\right)}=\dfrac{93,1\cdot85}{100}=79,135\left(kg\right)\)
Vậy khối lượng H2SO4 thực tế thu được là \(79,135kg\)
\(FeS_2+18HNO_3\rightarrow7H_2O+2H_2SO_4+15NO_2+Fe\left(NO_3\right)_3\)
Đổi \(60kg=60000g\)
Khối lượng FeS2 có trong 60kg quặng pirit là:
\(m_{FeS_2}=\dfrac{60000\cdot95}{100}=57000\left(g\right)\)
Số mol FeS2 là:
\(n_{FeS_2}=\dfrac{57000}{56+32\cdot2}=\dfrac{57000}{120}=475\left(mol\right)\)
Theo PTHH ta có:
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot475=950mol\)
Khối lượng của H2SO4 là:
\(m_{H_2SO_4}=950\left(2\cdot1+32+4\cdot16\right)=950\cdot98=93100\left(g\right)\)
Mà hiệu suất đạt 85%
Vậy khối lượng H2SO4 thực tế thu được là:
\(m_{H_2SO_4\left(tt\right)}=\dfrac{93100\cdot85}{100}=79135\left(g\right)\)

Khối lượng dung dịch H 2 SO 4 50% thu được :
100 tấn dung dịch có 50 tấn H 2 SO 4
x tấn ← 73,5 tấn
x = 73,5x100/50 = 147 tấn

\(m_{FeS_2}=0.6\left(tấn\right)=0.6\cdot10^3\left(kg\right)\)
\(n_{FeS_2}=\dfrac{0.6\cdot10^3}{120}=\dfrac{10^3}{200}\left(kmol\right)\)
Dựa vào sơ đồ phản ứng :
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot\dfrac{10^3}{200}=\dfrac{10^3}{100}=10\left(kmol\right)\)
\(m_{H_2SO_4\left(tt\right)}=10\cdot\dfrac{98}{80\%}=1225\left(kg\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{1225}{98\%}=1250\left(kg\right)=12.5\left(tấn\right)\)
\(m_{FeS_2}=\dfrac{1.60}{100}=0,6\left(tấn\right)\)
=> \(m_{FeS_2\left(pư\right)}=\dfrac{0,6.80}{100}=0,48\left(tấn\right)\)
Cứ 1 mol FeS2 điều chế được 2 mol H2SO4
=> 120g FeS2 điều chế được 196g H2SO4
=> 0,48 tấn FeS2 điều chế được 0,784 tấn H2SO4
=> \(m_{ddH_2SO_4}=\dfrac{0,784.100}{98}=0,8\left(tấn\right)\)
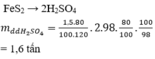
\(n_{FeS_2}=\dfrac{60}{120}\cdot85\%=0.425\left(kmol\right)\)
\(2FeS_2\rightarrow SO_2\rightarrow SO_3\rightarrow H_2SO_4\)
\(0.425...................................0.2125\)
\(m_{H_2SO_4}=0.2125\cdot98=20.825\left(kg\right)\)