Viết cấu hình electron của các nguyên tử, ion sau:Al(Z=13); Al3+;Cl (Z=17);Cl-?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cấu hình electron của các nguyên tử và các ion:
11Na : 1s22s22p63s1; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl : 1s22s22p63s23p5; Cl-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S : 1s22s22p63s23p4; S2-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al : 1s22s22p63s23p1; Al3+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O : 1s22s22p4; O2-: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.

Cấu hình electron của Al, Mg, Na, Ne :
Al 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 |
Mg 1 s 2 2 s 2 2 p 6 3 s 2 |
Na 1 s 2 2 s 2 2 p 6 3 s 1 |
Ne 1 s 2 2 s 2 2 p 6 |
Từ các cấu hình trên ta dễ dàng thấy rằng nếu :
nguyên tử Na nhường le để trở thành ion Na + ;
nguyên tử Mg nhường 2e để trở thành ion Mg 2 + ;
nguyên tử Al nhường 3e để trở thành ion Al 3 + ,
thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Ta đã biết cấu hình electron của các khí hiếm với 8 electron (đối với He là electron) ở lớp ngoài cùng là một cấu hình electron vững bền. Vì vậy, các nguyên tử kim loại có khuynh hướng dễ nhường electron để có cấu hình electron vững bền của khí hiếm đứng trước.

a) Na (Z = 11) 1s22s22p63s1 ⇒ Na+: 1s22s22p6.
Cl (Z = 17) 1s22s22p63s23p5 ⇒ Cl-: 1s22s22p63s23p6.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp p của Cl. AO đó là AO chứa 1 electron.
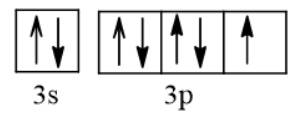

O: 1 s 2 2 s 2 2 p 4
F: 1 s 2 2 s 2 2 p 5
Ne: 1 s 2 2 s 2 2 p 6
Từ các cấu hình trên ta dễ dàng thấy rằng nếu nguyên tử F nhận thêm 1e để trở thành ion F - , nguyên tử O nhận thêm 2e để trở thành ion O 2 - thì các ion được hình thành có cấu hình electron giống cấu hình electron của khí hiếm Ne với 8 electron ở lớp ngoài cùng.
Như ta đã biết, cấu hình electron của các khí hiếm với 8 electron (đối với He là 2 electron) ở lớp ngoài cùng là một cấu hình electron vững bền (năng lượng thấp). Vì vậy, các nguyên tử phi kim có khuynh hướng nhận electron để có cấu hình electron vững bền của khí hiếm đứng sau.

Li: 1 s 2 2 s 1
Be: 1 s 2 2 s 2
Al: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1
Các nguyên tử trên có ít electron ở lớp ngoài cùng (1, 2, 3)
Các nguyên tố tương ứng là những kim loại.
Li và Be là các nguyên tố s, Al là nguyên tố p.


\(Al^{3+}:1s^22s^22p^6\\ Cl^-:1s^22s^22p^63s^23p^6\)