Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
• hhX gồm 0,3 mol H2 và 0,1 mol CH2=CH-C≡CH.
Nung X với Ni → hhY có dY/H2 = x.
hhY + 0,1 mol Br2 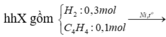

Ta có:
nH2 = 2x + y + 3[0,1 - (x + y + z)]
= 0,3 - (x + 2y + 3z) = 0,1
→ x + 2y + 3z = 0,2.
Ta có
∑nY = x + y + z + [0,1 - (x + y + z)] + [0,3 - (x + 2y + 3z)]
= 0,4 - (x + 2y + 3z) = 0,4 - 0,2 = 0,2 mol.
Theo BTKL:
mY = mX = 0,3 x 2 + 0,1 x 52 = 5,8 gam

Bài tập này vẫn khá dễ và hơi “kinh điển”
Nhìn chung các bài toán về các phản ứng cộng hidro, tách hidro, crakinh…của hidrocacbon vẫn có cách giải gần tương tự nhau, và ở bài toán này cũng như vậy
![]()
![]()
Xét tỉ lệ quen thuộc:
![]()
Bảo toàn số liêt kết pi ta có: nB =2.04 + 1.0,2-0,2 = 0,2 mol
![]()
![]()
Bài toán số liên kết pi ta có:
![]()
Đáp án D.

Đáp án A
X ![]() →
t
o
Y
→
t
o
Y
Có mX = mY → nY = ![]() = 0,24 mol
= 0,24 mol
Có nH2 pư = nX - nY = 0,4- 0,24 = 0,16 mol
bảo toàn liên kết π nBr2 = 0,1. 2- 0,16 = 0,04 mol .

Đáp án A
BTKL: mX = mY → nY = mX : MY = (0,1. 52 + 0,2. 56 + 0,3. 28 + 0,4. 2) : 32 = 0,8
→ n(khí giảm) = n(X) – n(Y) = n(pi p.ư) = 0,1 + 0,2 + 0,3 + 0,4 – 0,8 = 0,2
→ n(Pi trong Y) = n(Pi trong X) – n(Pi p.ư) = (0,1. 3 + 0,2. 2 + 0,3. 1) – 0,2 = 0,8 → a = 0,8
→ Các mệnh đề đúng là a, b, d.
X, Y là hợp chất đơn chức, Z là hợp chất tạp chức

Đáp án B
BTKL: Þ mY = mX = 0,1.26. + 0,2.28 + 0,3.2 = 8,8 (gam)
Þ MY = 11.2 = 22 Þ nY = 0,4 mol
Số mol H2 tham gia phản ứng là: nX – nY = (0,1 + 0,2 + 0,3) – 0,4 = 0,2 mol
![]()
![]()

Đáp án A
Theo BTKL:
mY = mX = 0,15 x 26 + 0,1 x 52 + 0,1 x 28 + 0,4 x 2 = 12,7 gam.
→ nY = 12,7 : 25,4 = 0,5 mol.
Ta có:
nπ trước phản ứng = 2 x nCH≡CH + 3 x nCH≡C-CH=CH2 + 1 x nCH2=CH2
= 2 x 0,15 + 3 x 0,1 + 1 x 0,1 = 0,7 mol.
→ nH2phản ứng = nX - nY = (0,15 + 0,1 + 0,1 + 0,4) - 0,5 = 0,25 mol.
nπ dư = nπ trước phản ứng - nH2 = 0,7 - 0,25 = 0,45 mol
→ nBr2 = 0,45 mol
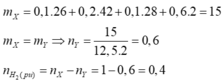
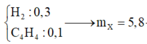
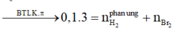
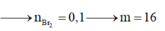
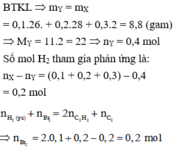
Đáp án D
BTKL:
=> a = 0,3