K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

16 tháng 10 2017
Đáp án C.
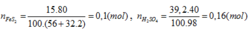
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

23 tháng 12 2018
Đáp án A.
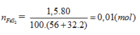
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%

HN
4 tháng 4 2022
Fe + S (0,04 mol) \(\underrightarrow{t^o}\) FeS (0,04 mol).
Số mol sắt (II) sunfua cần sản xuất là 3,52/88=0,04 (mol).
Khối lượng lưu huỳnh cần dùng trên lý thuyết là 0,04.32=1,28 (g).
Khối lượng quặng lưu huỳnh thực tế cần dùng là 1,28:90%:90%=128/81 (g).
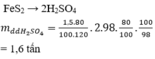



5 m3 = 5 000 000(ml)
n H2SO4 = 5 000 000.1,84.98%/98 = 92 000(mol) = 92(kmol)
Bảo toàn nguyên tố với S : n FeS2 = 1/2 n H2SO4 .80% = 36,8(kmol)
=> m pirit sắt = m FeS2/80% = 36,8.120/80% = 5520(kg)
Đáp án D